摘要: MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 2分 (2)2Cl2+2H2O+C4HCl+CO2, 2分 提供反应物水蒸气 2分 (3)生成HCl溶于水.溶液呈酸性.紫色石蕊试液变红,反应过程中.过量氯气溶于水中生成HClO有漂白性使紫色石蕊试液褪色 2分 (4)B 2分 (5)B中液面上方有黄绿色气体.B中液面下降.长颈漏斗中液面上升.2分 暂时储存残余氯气.防止空气污染.避免因压强过大而产生危险. 2分
网址:http://m.1010jiajiao.com/timu3_id_202453[举报]
X、Y、Z、W是原子序数依次增大的短周期元素,元素X的一种原子核内无中子,元素Y最外层电子数是次外层的2倍,X与W可形成X2W和X2W2两种常见的液态化合物.下列有关叙述不正确的是( )
查看习题详情和答案>>
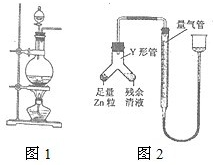 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).(1)制备实验开始时,先检查装置气密性,接下来的操作依次是
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
制备反应会因盐酸浓度下降而停止.为测定已分离出过量MnO2后的反应残余液中盐酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量.
乙方案:与已知量CaCO3(过量)反应,称量剩余固体的质量.
丙方案:与足量Zn反应,测量生成的H2体积.
继而进行下列判断和实验:
(2)判定甲方案不可行,理由是
(3)乙方案的实验发现,固体中含有MnCO3,说明碳酸钙在水中存在
进行丙方案实验:装置如图2所示(夹持器具已略去).
(4)使Y形管中的残余清液与锌粒反应的正确操作是将
(5)反应完毕,每间隔1分钟读取气体体积,发现气体体积逐渐减小,直至不变.气体体积逐次减小的原因是
(排除装置和实验操作的影响因素).
(6)小组内又有同学提出还可采用酸碱中和滴定法测定残余液中盐酸的浓度,但还需经查阅资料知道:
下列甲组、乙组中的两种试剂分别混合,甲组能产生气体,乙组气体会被吸收的是( )
| 甲 | 乙 | |
| A | 稀硫酸和铜 | 浓氨水和SO2 |
| B | 浓盐酸和MnO2 | BaCl2溶液和SO2 |
| C | 冷的浓硝酸和铝 | NaOH溶液和Cl2 |
| D | 浓硫酸和蔗糖(滴有几滴水) | 水和氨气 |
| A、A | B、B | C、C | D、D |
氰气的化学式为(CN)2,它的性质和卤素相似,称为拟卤素,对其性质和有关化合物性质的叙述不正确的是( )
| A、NaCN和AgCN都易溶于水 | B、HCl和HCN都易形成白雾? | C、MnO2可与HCN反应生成(CN)2 | D、(CN)2和NaOH溶液反应生成NaCN、NaCNO和H2O |
下列各项表述中与示意图一致的是( )
A、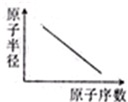 表示IA族元素原子半径的变化规律 | B、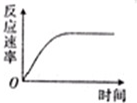 表示MnO2和热的浓盐酸反应时,反应速率随时间的变化 | C、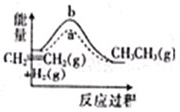 a、b曲线分别表示反应:CH2 CH2(g)+H2(g)→CH3CH3(g)△H<O在使用和未使用催化剂时,反应过程中的能量变化 | D、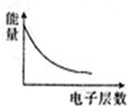 表示核外电子能量与电子层数的关系 |