摘要:在反应3NO2+H2O=2HNO3+NO中.NO2的作用是 A.只作氧化剂 B.既是氧化剂又是还原剂 C.只作还原剂 D.既不是氧化剂也不是还原剂
网址:http://m.1010jiajiao.com/timu3_id_201915[举报]
 (2013?朝阳区一模)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
(2013?朝阳区一模)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.(1)用化学方程式表示NO形成硝酸型酸雨的反应
2NO+O2═2NO2、3NO2+H2O═2HNO3+NO
2NO+O2═2NO2、3NO2+H2O═2HNO3+NO
(2)能作脱除剂的物质很多,下列说法正确的是
ab
ab
a.用 H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用 Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
(3)尿素[CO(NH2)2]在一定条件下能有效将NOx转化为N2.
Ⅰ.已知可通过下列方法合成尿素:
2NH3(g)+CO2(g)?H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)?CO(NH2)2(s)+H2O(l)△H=+28.5kJ/mol
①尿素释放出NH3的热化学方程式是
CO(NH2)2(s)+H2O(l)?2NH3(g)+CO2(g)△H=+131kJ/mol
CO(NH2)2(s)+H2O(l)?2NH3(g)+CO2(g)△H=+131kJ/mol
②写出有利于尿素释放NH3的条件并说明理由
升高温度;升高温度有利于平衡向吸热反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行
升高温度;升高温度有利于平衡向吸热反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行
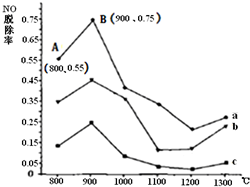
Ⅱ.CO(NH2)2与某种烟气(主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
①曲线a 对应CO(NH2)2 与NO的物质的量比值是
3:1
3:1
.②曲线a、b、c中,800℃~900℃区间内发生主要反应的化学方程式是
4NH3+6NO═5N2+6H2O或2CO(NH2)2+6NO═2CO2+4H2O+5N2
4NH3+6NO═5N2+6H2O或2CO(NH2)2+6NO═2CO2+4H2O+5N2
.③900℃~1200℃区间内脱除率下降,NO浓度上升.发生的主要反应是
4NH3+5O2═4NO+6H2O
4NH3+5O2═4NO+6H2O
.④曲线a中,NO的起始浓度为6×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为
1.5×10-4
1.5×10-4
mg/(m3?s).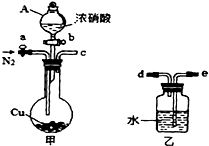 (2012?宁德模拟)某化学课外小组利用如图实验装置(夹持仪器略去),探究铜与浓硝酸反应是否有NO生成.
(2012?宁德模拟)某化学课外小组利用如图实验装置(夹持仪器略去),探究铜与浓硝酸反应是否有NO生成.请回答下列问题:
(1)仪器A的名称是
分液漏斗
分液漏斗
.(2)甲装置的c应该与乙装置的
e
e
连接(填“d”或“e”).(3)乙装置中反应的化学方程式是
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.(4)实验步骤如下:
i仪器组装完毕,检查装置的气密性,加入试剂.打开旋塞a,通入N2一段时间后,关闭旋塞a.
ii打开旋塞b,滴加入xmol?L-1浓硝酸V mL,充分反应后冷却,固体仍有剩余.
iii用NaOH溶液滴定乙装置中溶液,得溶质的物质的量为n mol.
①步骤i通入N2的目的是
赶尽装置中的空气
赶尽装置中的空气
②为了准确测定甲装置中产生NO2的量,在步骤ii和iii之间应补充的操作是:
打开a,关闭b,通入N2一段时间
打开a,关闭b,通入N2一段时间
.③当xV×l0-3
>
>
3n(填“>”、“=”或“<”),则证明铜与浓硝酸反应时有NO生成.④该实验设计中存在一个明显的缺陷是
缺少尾气吸收装置
缺少尾气吸收装置
.短周期元素形成的纯净物A、B、C、D、E之间的转化关系如图1所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同).

请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的化学式
(2)若E是有臭鸡蛋气味的气体硫化氢(其水溶液为二元弱酸),D是既能溶于强酸、又能溶于强碱的化合物.
用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系
(3)若C是一种红棕色气体,D是一种强酸,则:
①C与水反应的化学方程式为
②有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用右图装置进行实验(反应前Ⅰ、Ⅱ装置中空气已排尽).实验进行一段时间后,浓H2SO4中未发现有气体逸出,且该溶液变为红棕色,则你得出的结论是
③已知A与物质B及水作用生成D,写出此反应的化学方程式
查看习题详情和答案>>

请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的化学式
Na2O2(NaH)
Na2O2(NaH)
.(2)若E是有臭鸡蛋气味的气体硫化氢(其水溶液为二元弱酸),D是既能溶于强酸、又能溶于强碱的化合物.
用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系
c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
.(3)若C是一种红棕色气体,D是一种强酸,则:
①C与水反应的化学方程式为
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.②有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用右图装置进行实验(反应前Ⅰ、Ⅱ装置中空气已排尽).实验进行一段时间后,浓H2SO4中未发现有气体逸出,且该溶液变为红棕色,则你得出的结论是
NO2能溶于浓H2SO4,因而不能用浓H2SO4干燥NO2
NO2能溶于浓H2SO4,因而不能用浓H2SO4干燥NO2
.③已知A与物质B及水作用生成D,写出此反应的化学方程式
4NO+3O2+2H2O=4HNO3
4NO+3O2+2H2O=4HNO3
.