网址:http://m.1010jiajiao.com/timu3_id_201821[举报]
(I) 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1) 写出该反应的化学方程式 。
(2) 检验溶液中Fe3+存在的试剂是 ,证明Fe3+存在的现象是 。
(Ⅱ) 印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。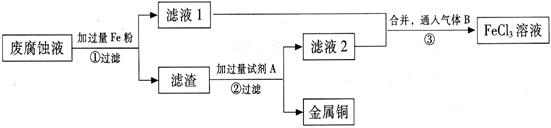
⑴ 步骤①中发生反应的离子方程式 。
(2) 步骤②需加入的试剂A是 (填化学式)。
(3) 步骤③通入的气体B是 (填化学式),写出该反应的化学方程式 。
(4) 为测定滤渣中铜的质量分数,取50g的滤渣与足量的试剂A反应,得到5.6L气体(标准状况下),试计算滤渣中铜的质量分数。
(I) 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1) 写出该反应的化学方程式 。
(2) 检验溶液中Fe3+存在的试剂是 ,证明Fe3+存在的现象是 。
(Ⅱ) 印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。

⑴ 步骤①中发生反应的离子方程式 。
(2) 步骤②需加入的试剂A是 (填化学式)。
(3) 步骤③通入的气体B是 (填化学式),写出该反应的化学方程式 。
(4) 为测定滤渣中铜的质量分数,取50g的滤渣与足量的试剂A反应,得到5.6L气体(标准状况下),试计算滤渣中铜的质量分数。
查看习题详情和答案>>
(1) 写出该反应的化学方程式 。
(2) 检验溶液中Fe3+存在的试剂是 ,证明Fe3+存在的现象是 。
(Ⅱ) 印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。

⑴ 步骤①中发生反应的离子方程式 。
(2) 步骤②需加入的试剂A是 (填化学式)。
(3) 步骤③通入的气体B是 (填化学式),写出该反应的化学方程式 。
(4) 为测定滤渣中铜的质量分数,取50g的滤渣与足量的试剂A反应,得到5.6L气体(标准状况下),试计算滤渣中铜的质量分数。
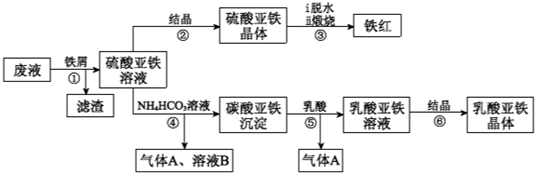
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-.请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、
(2)步骤④的离子方程式是
(3)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及
(4)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为
(5)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因
(6)为测定步骤②中所得晶体中FeSO4?7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应).若消耗0.1000mol?L-1 KMnO4溶液20.00mL,所得晶体中FeSO4?7H2O的质量分数为(用a表示)
| 13.9 |
| a |
| 13.9 |
| a |
 运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:
运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:(1)已知水存在如下平衡:H2O?H++OH-△H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol?L-1]D.向水中加入NH4Cl固体
(2)常温下,浓度均为0.1mol?L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.CH3COOH D.H2CO3
(3)实验室中常用NaOH来进行洗气和提纯.当400mL 1mol?L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为
(4)实验室中采用惰性电极模拟工业上电解饱和食盐水的过程:
①写出C1电极上发生反应的电极反应式
②当C2电极上产生112mL(标准状况)气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=