网址:http://m.1010jiajiao.com/timu3_id_201739[举报]
 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表,回答下列问题:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表,回答下列问题:| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)能判断该反应达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中c(CO)不变
c.v(H2)正=v(H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:0.9?c(CO2)?c(H2)=c(CO)?c(H2O),由此可以判断此时的温度为
问题1 工业生产碘酸钾的流程如下:
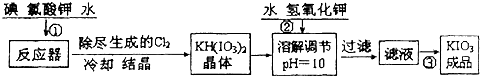
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同.请写出反应器中发生反应的化学方程式:
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
| O | 2- 3 |
| O | 2- 6 |
(1)测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.则加碘食盐样品中的碘元素含量是
| 1270 |
| 3W |
| 1270 |
| 3W |
(2)学生乙又进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
②根据学生乙的实验结果,请对学生甲的实验结果作出简要评价:
其原因是
“关注民生”和“科学发展”是“十七大”报告的主题之一,环境问题与“民生”和“科学发展”密切相关。世界环保组织2006年度报告指出,在所有衡量地球健康状况的指标中,人类仅成功地扭转了一项指标的恶化-大气中氯氟烃减少,而C、S、N氧化物的排放有增无减,水资源的紧缺和污染加剧。保证经济走可持续发展的道路,是化学工作者应尽的职责所在。回答下列问题:
(1)大气中氯氟烃的减少带来的积极效果是 ;
(2) 酸雨的化学特征是 。空气中硫氧化物和氮氧化物是形成酸雨的主要物质。若用NOx表示氮氧化物,请写出空气中氮氧化物形成酸雨的化学方程式
;
(3) SO2是有用的化工原料,回收利用SO2既能减少大气污染,又能充分利用资源。有学者提出利用Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO42-而实现SO2的回收利用。某研究性学习小组设计如下方案,在实验室条件下测定转化器的脱硫效率:

① 在实验室测定模拟烟气中SO2的体积分数,现有注射器、洗气瓶、导管、量筒等仪器,需要的药品有 ;
② 若上述实验是在标准状况下进行的,欲测定转化器中的脱硫效率,已知气体流速,还需测定的数据是 ;
(4)水体富营养化是导致水体藻类大量繁殖的主要因素。2007年春夏之交我省无锡太湖蓝藻事件再次给水资源保护敲响警钟。检测显示,蓝藻爆发时太湖全湖N、P平均含量分别高达4.0和0.13 mg/L。环境专家建议用金属镁将水体中的NO3-还原为N2而消除污染,Mg则转变为Mg(OH)2沉降湖底。要使太湖水中N的平均含量下降至0.20 mg/L,则每立方米水体中应投入的镁粉应不少于 g。
查看习题详情和答案>>(1)已知:
N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ/mol;
2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ/mol;
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol。
尾气转化的反应之一:2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH__________。
(2)某研究性学习小组在技术人员的指导下,按下列流程探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果。

②在一定条件下,测得尾气中的主要污染物的转化率与空燃比的关系如图所示。空燃比约为_______时,催化剂对汽车尾气的催化效果最好。


B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在表格中填入剩余的实验条件数据。

已知A、E是生活中常见的两种有机物;B是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平;A能在酸性高锰酸钾的条件下生成E; C是高分子化合物。在一定条件下由A可以转变为有机物B、C、D、E、F(A、B、D、E碳原子数相等)。转变关系如下:


请回答下列问题:
(1)B的电子式是____________。
(2) E的官能团名称是____________。
(3) 写出实现下列转化的化学方程式
①A→D
② B→C
(4) A是一种高效、低耗、污染小的可再生的清洁能源,已知1molA完全燃烧生成CO2气体和水蒸气放出1367kJ热量,则在相同条件下,1molA完全燃烧生成CO2气体和液态水,放出的热量________ 1367kJ(填“>”、“=”或“<”)。
(5) 在可逆反应当中,产率指的是某种生成物的实际产量与理论产量的比值.若100克A和120克E反应生成了88克F,则F的产率是____________(用百分数表示)
(6)下列关于A、B、C、D、E、F六种物质说法正确的是____________
A.C具有固定的元素组成,因而有固定的熔沸点
B.C中有不饱和键,所以能使高锰酸钾溶液褪色
C. 取等物质的量的B和C完全燃烧后,生成的CO2和H2O的物质的量分别相等
D.由B生成C是通过加聚反应制得的
E. 分别燃烧1molA和B生成CO2和H2O的耗氧气量,其中A和B耗氧量相等
F.在 A+E→ F转变中,有含氧的小分子生成,小分子的氧原子来至于A
查看习题详情和答案>>