网址:http://m.1010jiajiao.com/timu3_id_201280[举报]
 已知如表所示数据:
已知如表所示数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g?cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | - | 338.0 | 1.84 |
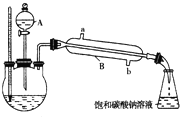
①在三颈烧瓶中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合液80mL.
②按如图所示连接好装置(装置气密性良好,加热以及夹持装置省略),用小火均匀加热装有混合液的三颈烧瓶5~10min.
③边加热,边从仪器A向三颈烧瓶中滴加乙醇.
④待锥形瓶收集到一定量产物后停止加热,用力振荡锥形瓶,然后静置待分层.
⑤分离出乙酸乙酯层,洗涤、干燥.
请根据题目要求回答下列问题:
(1)仪器A使用前必须进行的操作是
(2)仪器B的名称是
(3)乙醇与乙酸反应的化学方程式是
(4)实验完成后,锥形瓶里液面上有透明的不溶于水的油状液体,若分离油状液体混合物,需要用到的主要玻璃仪器是
(5)用30g乙酸与46g乙醇反应,如果实际产量是理论产量的67%,则实际得到乙酸乙酯的质量是
A.44g B. 29.3g C.74.8g D.88g. 查看习题详情和答案>>
 Na2S2O3,常温下溶液中析出晶体为Na2S2O3?5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。
Na2S2O3,常温下溶液中析出晶体为Na2S2O3?5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
(1)仪器2的名称为 ,
装置6中可放入 。
| A.BaCl2溶液 | B.浓H2SO4 | C.酸性KMnO4溶液 | D.NaOH溶液 |

(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2 =Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3+S
 Na2S2O3
Na2S2O3总反应为:2Na2S+Na2CO3+4SO2= 3Na2S2O3+CO2
随着二氧化硫气体的通入,看到溶液中有大量浅黄色固体析出,继续通二氧化硫气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液PH要控制不小于7理由是
(用离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并标定溶液的浓度:
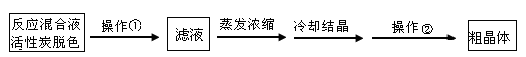
(1)为减少产品的损失,操作①为 ,操作②是抽滤洗涤干燥,其中洗涤操作是用
(填试剂)作洗涤剂。
(2)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高
(3)称取一定质量的产品配置成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准
确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加
水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴
淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,滴定终点的现象为
三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液
的浓度为 mol/L。
A:
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac
请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为
(2)写出基态Cu+的核外电子排布式
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为
(4)写出与CO互为等电子体的离子
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子轨道的杂化类型分别为
(6)铜金合金形成的晶胞如图1所示,其中Cu、Au原子个数比为
B:
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到.
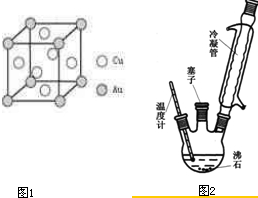
实验室可利用如图2实验装置合成对氨基苯磺酸.实验步骤如下:
1在一个250mL三颈烧瓶中加入10mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18mL浓硫酸.
2将三颈烧瓶置于油浴中缓慢加热至170~180℃,维持此温度2~2.5h.
③将反应液冷却至约50℃后,倒入盛有100mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品.
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干.(说明:100mL水在20℃时可溶解对氨基苯磺酸1.08g,在100℃时可溶解6.67g.)
试回答填空.
(1)装置中冷凝管的作用是
(2)步骤②中采用油浴加热,下列说法正确的是
A.用油浴加热的好处是反应物受热均匀,便于控制温度
B.此处也可以改用水浴加热
C.实验装置中的温度计可以改变位置,也可使其水银球浸入在油中
(3)步骤③用少量冷水洗涤晶体的好处是
(4)步骤③和④均进行抽滤操作,在抽滤完毕停止抽滤时,应注意先
(5)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是
不同物质的溶解度会随温度的变化而发生不同的变化,利用这一性质,我们可以将物质进行分离和提纯。工业上制取
硝酸钾就是利用了该原理。请你回答以下问题:
1.右图是几种盐的溶解度曲线,下列说法正确是
(A)40℃时,将35克食盐溶于100克水中,降温至0℃时,可析 出氯化钠晶体
(B)20℃时,硝酸钾饱和溶液的质量百分比浓度是31.6%
(C)60℃时,200克水中溶解80克硫酸铜达饱和.当降温至30℃时,可析出30克硫酸铜晶体
(D)30℃时,将35克硝酸钾和35克食盐同时溶于100克水中, 蒸发时,先析出的是氯化钠
2.从右图曲线中可以分析得到KNO3和NaCl的溶解度随温度变化的关系是 。
3.请填写空白。
步骤 | 操作 | 具体操作步骤 | 现象解释结论等 |
① |
溶解 | 取20克NaNO3和17克KCl溶解在35ml水中,加热至沸,并不断搅拌。 | NaNO3和KCl溶于水后产生四种离子,这四种离子可能组成四种物质 、 、 、 。这四种物质在不同温度下的溶解度特点 |
② | 蒸发 | 继续加热搅拌,使溶液蒸发浓缩。 | 有 晶体析出。 |
③ |
| 当溶液体积减少到约原来的一半时,迅速趁热过滤 | 滤液中的最主要成分为 。 |
④ | 冷却 | 将滤液冷却至室温。 | 有 晶体析出。尚有少量的 析出。 |
⑤ |
| 按有关要求进行操作 | 得到初产品硝酸钾晶体(称量为m1) |
⑥ |
| 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤。 |
得到纯度较高的硝酸钾晶体(称量为m2) |
⑦ |
检验 | 分别取⑤、⑥得到的产品,配置成溶液后分别加入1d1mol/l的HNO3和2d0.1mol/l的AgNO3 | 可观察到⑤、⑥产品中出现的现象分别是
|
(1)检验所得产品中是否Cl-的目的是 。结合⑤、⑥步实验得到的产品质量,计算初产品的纯度为 。(不考虑损失)
(2)步骤③过滤使用了保温漏斗,用图所示装置,其主要作用是

(3)步骤③过滤装置如图1―8所示,采用这种装置过滤的主要目的是 
这种装置工作的主要原理是
(4)玻璃棒在实验中一般有如下三种用途:搅拌、引流和蘸取溶液,上述实验步骤中一般需要用到玻璃棒的是_______________(填代号).
查看习题详情和答案>>A【物质结构与性质】纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
 ⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了 。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为 。
 ⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由 。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
B【实验化学】某化学研究性学习小组为测定果汁中Vc含量,设计并进行了以下实验。
Ⅰ 实验原理
 将特定频率的紫外光通过装有溶液的比色皿,一部分被吸收,通过对比入射光强度和透射光强度之间的关系可得到溶液的吸光度(用A表示,可由仪器自动获得)。吸光度A的大小与溶液中特定成分的浓度有关,杂质不产生干扰。溶液的pH对吸光度大小有一定影响。
将特定频率的紫外光通过装有溶液的比色皿,一部分被吸收,通过对比入射光强度和透射光强度之间的关系可得到溶液的吸光度(用A表示,可由仪器自动获得)。吸光度A的大小与溶液中特定成分的浓度有关,杂质不产生干扰。溶液的pH对吸光度大小有一定影响。
Ⅱ 实验过程
⑴配制系列标准溶液。分别准确称量质量为1.0mg、1.5mg、2.0mg、2.5mg的标准Vc试剂,放在烧杯中溶解,加入适量的硫酸,再将溶液完全转移到100mL容量瓶中定容。
上述步骤中所用到的玻璃仪器除烧杯、容量瓶外还有 。
⑵较正分光光度计并按顺序测定标准溶液的吸光度。为了减小实验的误差,实验中使用同一个比色皿进行实验,测定下一溶液时应对比色皿进行的操作是 。测定标准溶液按浓度 (填“由大到小”或“由小到大”)的顺序进行。
⑶准确移取10.00mL待测果汁样品到100mL容量瓶中,加入适量的硫酸,再加水定容制得待测液,测定待测液的吸光度。
Ⅲ 数据记录与处理
 ⑷实验中记录到的标准溶液的吸光度与浓度的关系如下表所示,根据所给数据作出标准溶液的吸光度随浓度变化的曲线。
⑷实验中记录到的标准溶液的吸光度与浓度的关系如下表所示,根据所给数据作出标准溶液的吸光度随浓度变化的曲线。
| 标准试剂编号 | ① | ② | ③ | ④ | 待测液 |
| 浓度mg/L | 10 | 15 | 20 | 25 | — |
| pH | 6 | 6 | 6 | 6 | 6 |
| 吸光度A | 1.205 | 1.805 | 2.405 | 3.005 | 2.165 |
⑸原果汁样品中Vc的浓度为 mg/L
⑹实验结果与数据讨论
除使用同一个比色皿外,请再提出两个能使实验测定结果更加准确的条件控制方法 。
查看习题详情和答案>>