摘要:19.在反应4FeS2+11O2 === 2Fe2O3+8SO2中.其中.FeS2中硫为-1价.该反应的氧化产物和还原产物的质量比为 A.4∶11 B.1∶4 C.1∶1 D.4∶1
网址:http://m.1010jiajiao.com/timu3_id_201012[举报]
硫铁矿在高温下用空气氧化产生二氧化硫,4FeS2+11O2====8SO2+2Fe2O3。设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示)。试完成下列各题。
(1)1.00 mol FeS2完全氧化,需要空气的体积(标准状况)为________ L。
(2)55 L空气和足量FeS2完全反应后,气体体积(同温同压)变为________ L。
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
(4)设FeS2氧化产生的气体混合物为100 L,其中O2为a L,SO2为b L。
①写出a和b的关系式。
②在下图中画出a和b的关系曲线(FeS2氧化时,空气过量20%)。
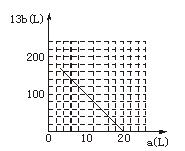
说明:为方便作图,纵坐标用13b表示。
查看习题详情和答案>>