题目内容
在反应4FeS2+11O2═2Fe2O3+8SO2中,其中,FeS2中硫为-1价.该反应的氧化产物总质量和还原产物总质量比为
- A.4:11
- B.1:4
- C.1:1
- D.4:1
C
分析:在反应4FeS2+11O2═2Fe2O3+8SO2中,Fe的化合价由+2价→+3价,S的化合价由-1价→+4价,O的化合价由0价→-2价,
则Fe2O3和SO2既是氧化产物,又是还原产物.
解答:在反应4FeS2+11O2═2Fe2O3+8SO2中,电子转移的情况为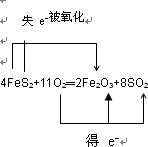 ,Fe的化合价由+2价→+3价,S的化合价由-1价→+4价,O的化合价由0价→-2价,
,Fe的化合价由+2价→+3价,S的化合价由-1价→+4价,O的化合价由0价→-2价,
则氧化产物为Fe2O3和SO2,还原产物也为Fe2O3和SO2,则反应的氧化产物总质量和还原产物总质量比为1:1,
故选C.
点评:本题考查氧化还原反应的计算,题目难度不大,注意元素化合价的分析,可通过化合价的变化判断氧化产物和还原产物直接判断,无需计算可的结果.
分析:在反应4FeS2+11O2═2Fe2O3+8SO2中,Fe的化合价由+2价→+3价,S的化合价由-1价→+4价,O的化合价由0价→-2价,
则Fe2O3和SO2既是氧化产物,又是还原产物.
解答:在反应4FeS2+11O2═2Fe2O3+8SO2中,电子转移的情况为
 ,Fe的化合价由+2价→+3价,S的化合价由-1价→+4价,O的化合价由0价→-2价,
,Fe的化合价由+2价→+3价,S的化合价由-1价→+4价,O的化合价由0价→-2价,则氧化产物为Fe2O3和SO2,还原产物也为Fe2O3和SO2,则反应的氧化产物总质量和还原产物总质量比为1:1,
故选C.
点评:本题考查氧化还原反应的计算,题目难度不大,注意元素化合价的分析,可通过化合价的变化判断氧化产物和还原产物直接判断,无需计算可的结果.

练习册系列答案
相关题目