摘要:8.已知金属氢氧化物胶体粒子带正电荷.下列方法不能使Fe(OH)3胶体发生聚沉现象的是( ) A.加热 B.加Al(OH)3胶体 C.加Na2SO4溶液 D.搅拌
网址:http://m.1010jiajiao.com/timu3_id_200605[举报]
欲降低废水中重金属元素铬的毒性,可将Cr2O2-7转化为Cr(OH)3沉淀除去.
已知:
(1)某含铬废水处理的主要流程如图所示:
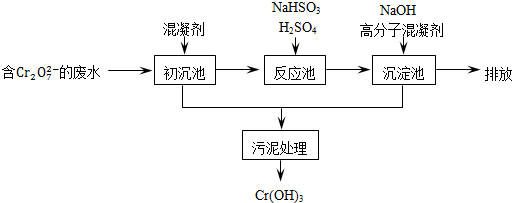
①沉池中加入的混凝剂是K2SO4?Al2(SO4)3?24H2O,用离子方程式表示其反应原理
②反应池中发生主要反应的离子方程式是Cr2O2-7+3HSO-3+5H+═2Cr3++3SO2-4+H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是
(2)工业亦可用电解法来处理含Cr2O2-7废水.实验室利用如图模拟处理含Cr2O2-7的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-=H2↑.Fe2+与酸性溶液中的Cr2O2-7反应生成Cr3+和Fe3+,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是:
用电解法处理该溶液中0.01molCr2O2-7时,至少得到沉淀的质量是

查看习题详情和答案>>
已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | Fe2+ | 7.0 | 9.0 | Fe3+ | 1.9 | 3.2 | Cr3+ | 6.0 | 8.0 |

①沉池中加入的混凝剂是K2SO4?Al2(SO4)3?24H2O,用离子方程式表示其反应原理
Al3++3H2O?Al(OH)3(胶体)+3H+
Al3++3H2O?Al(OH)3(胶体)+3H+
.②反应池中发生主要反应的离子方程式是Cr2O2-7+3HSO-3+5H+═2Cr3++3SO2-4+H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是
Cr3++3OH-═Cr(OH)3↓
Cr3++3OH-═Cr(OH)3↓
、H++OH-═H2O
H++OH-═H2O
.证明Cr3+沉淀完全的方法是测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
.(2)工业亦可用电解法来处理含Cr2O2-7废水.实验室利用如图模拟处理含Cr2O2-7的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-=H2↑.Fe2+与酸性溶液中的Cr2O2-7反应生成Cr3+和Fe3+,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是:
阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
.用电解法处理该溶液中0.01molCr2O2-7时,至少得到沉淀的质量是
8.48
8.48
g.
高纯碳酸锰广泛应用于电子工业,是制造高性能磁性材料的主要原料.新工艺采用工业冶铜后的废气SO2进行湿法浸取软锰矿(主要含MnO2,同时含有少量SiO2、Fe2O3、Al2O3)来制备.(已知亚硫酸酸性强于碳酸)
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后过滤分离;
③调节滤液pH值为6.5~7.2,然后加入NH4HCO3,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰.
工业流程图如下:

已知生成氢氧化物的pH如下表:
请根据题中有关信息回答问题:
(1)“浸锰”后所得混合液中主要存在的金属阳离子有
(2)由图可知,副反应MnSO4+SO2 MnS2O6的△H
MnS2O6的△H
(3)步骤②中加入MnO2和通入空气的作用
(4)③中控制温度为60~70℃,温度不宜太高的原因是
(5)与传统的电解法制MnCO3工艺相比较,新工艺的优点是
查看习题详情和答案>>
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后过滤分离;
③调节滤液pH值为6.5~7.2,然后加入NH4HCO3,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰.
工业流程图如下:

已知生成氢氧化物的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
(1)“浸锰”后所得混合液中主要存在的金属阳离子有
Mn2+、Fe2+、Al3+
Mn2+、Fe2+、Al3+
.(2)由图可知,副反应MnSO4+SO2
 MnS2O6的△H
MnS2O6的△H<
<
0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是150℃
150℃
.(3)步骤②中加入MnO2和通入空气的作用
加入MnO2是为了除去过量的SO2;通入空气将Fe2+氧化成Fe3+便于后来加碳酸钠除去
加入MnO2是为了除去过量的SO2;通入空气将Fe2+氧化成Fe3+便于后来加碳酸钠除去
.(4)③中控制温度为60~70℃,温度不宜太高的原因是
防止NH4HCO3受热分解
防止NH4HCO3受热分解
.(5)与传统的电解法制MnCO3工艺相比较,新工艺的优点是
综合利用了尾气SO2有利于环境保护,同时节约能源
综合利用了尾气SO2有利于环境保护,同时节约能源
(写两点).欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.已知:
(1)某含铬废水处理的主要流程如图所示:
①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,用离子方程式表示其反应原理是
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是
(2)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是
查看习题详情和答案>>
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |

①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,用离子方程式表示其反应原理是
Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
.②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是
Cr3++3OH-═Cr(OH)3↓、H++OH-═H2O
Cr3++3OH-═Cr(OH)3↓、H++OH-═H2O
.证明Cr3+沉淀完全的方法是测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
.
(2)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
.用电解法处理该溶液中0.01mol Cr2O72-时,至少得到沉淀的质量是8.48
8.48
g.某课外活动小组欲降低废水中重金属元素铬的含量,查阅资料知,可将Cr2
转化为Cr(OH)3沉淀除去.
已知:
(1)将含铬废水进行如下处理:
①在废水中加入的混凝剂是一种复盐,将其配成溶液后加入过量的NaOH溶液,产生先有白色沉淀生成,后沉淀溶解的现象.用离子方程式表示该盐产生上述现象的反应原理:
②将废水中的Cr2
转化成Cr3+.配平该离子方程式:
+
③向转化后的废水中加入NaOH溶液,此过程中发生的主要反应的离子方程式是
(2)工业上可用电解法来处理含Cr2
的废水.实验室利用如图所示的装置模拟处理含Cr2
的废水.

①阳极反应式是
②Fe2+与酸性溶液中的Cr2
反应的离子方程式是
时,至少得到沉淀的质量是
查看习题详情和答案>>
| O | 2- 7 |
已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物开始沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
①在废水中加入的混凝剂是一种复盐,将其配成溶液后加入过量的NaOH溶液,产生先有白色沉淀生成,后沉淀溶解的现象.用离子方程式表示该盐产生上述现象的反应原理:
Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═2H2O+AlO2-
Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═2H2O+AlO2-
.②将废水中的Cr2
| O | 2- 7 |
1
1
Cr2| O | 2- 7 |
3
3
HSO3-+5
5
H+=2
2
Cr3++3
3
SO42-+4
4
H2O
H2O
③向转化后的废水中加入NaOH溶液,此过程中发生的主要反应的离子方程式是
Cr3++3OH-═Cr(OH)3↓
Cr3++3OH-═Cr(OH)3↓
、H++OH-═H2O
H++OH-═H2O
.证明Cr3+沉淀完全的方法是测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
.(2)工业上可用电解法来处理含Cr2
| O | 2- 7 |
| O | 2- 7 |

①阳极反应式是
Fe-2e-═Fe2+
Fe-2e-═Fe2+
,阴极反应式是2H++2e-═H2↑
2H++2e-═H2↑
.②Fe2+与酸性溶液中的Cr2
| O | 2- 7 |
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
.用电解法处理该溶液中的0.01molCr2| O | 2- 7 |
8.48
8.48
g.高纯碳酸锰广泛应用于电子工业,是制造高性能磁性材料的主要原料。新工艺采用工业冶铜后的废气SO2进行湿法浸取软锰矿(主要含MnO2,同时含有少量SiO2、Fe2O3、Al2O3)来制备。(已知亚硫酸酸性强于碳酸)
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后
过滤分离;
③调节滤液pH值为6.5~7.2 ,然后加入NH4HCO3 ,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰。
工业流程图如下:


已知生成氢氧化物的pH如下表:
|
物质 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
8.3 |
|
完全沉淀pH |
3.7 |
9.6 |
9.8 |
请根据题中有关信息回答问题:
(1)“浸锰”后所得混合液中主要存在的金属阳离子有 。
(2)由图可知,副反应MnSO4+
SO2  MnS2O6的△H 0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是
。
MnS2O6的△H 0(填>、<或=),为减少MnS2O6 的生成,“浸锰”的适宜温度是
。
(3)步骤②中加入MnO2和通入空气的作用 。
(4)③中控制温度为60~70℃,温度不宜太高的原因是 。
(5)与传统的电解法制MnCO3工艺相比较,新工艺的优点是 (写两点)。
查看习题详情和答案>>