摘要:蒸馏是实验室制备蒸馏水的常用方法. ⑴图I是实验室制取蒸馏水的常用装置. 图中明显的错误是 . ⑵仪器A的名称是 .仪器B的名称是 . ⑶实验时A中除加入少量自来水外.还需加入少量 . 其作用是 . ⑷图II装置也可用于少量蒸馏水的制取. 其原理与图I完全相同.该装置中使用的玻璃导管较长.其作 用是 ,烧杯中还应盛有的物质是 .
网址:http://m.1010jiajiao.com/timu3_id_199121[举报]
实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气.某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气.供选用的实验试剂及装置如下(部分导管、蒸馏水略):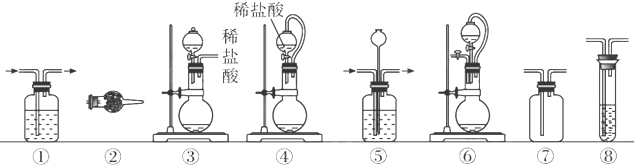
a、Na2O2 b、浓盐酸 c、碱石灰 d、NaOH溶液 e、淀粉-KI溶液 f、CaCO3
g、石蕊试液 h、饱和NaCl溶液
(1)写出用Na2O2与浓盐酸制备氯气的化学方程式
(2)下列装置组合最合理的是
(3)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为:
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①
②
查看习题详情和答案>>

a、Na2O2 b、浓盐酸 c、碱石灰 d、NaOH溶液 e、淀粉-KI溶液 f、CaCO3
g、石蕊试液 h、饱和NaCl溶液
(1)写出用Na2O2与浓盐酸制备氯气的化学方程式
Na2O2+4HCl═2NaCl+Cl2↑+2H2O
Na2O2+4HCl═2NaCl+Cl2↑+2H2O
.(2)下列装置组合最合理的是
D
D
(填序号,需考虑实验结束撤除装置时残留有害气体的处理).| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/g | ① |
2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2H2O═4NaOH+O2↑
.(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①
Na2O2能与水反应,会使原料的利用率降低
Na2O2能与水反应,会使原料的利用率降低
,②
双氧水比Na2O2更经济
双氧水比Na2O2更经济
.实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应式如下:
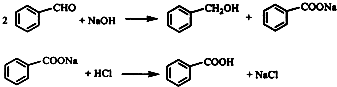
已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃).
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸.
③石蜡油沸点高于250℃
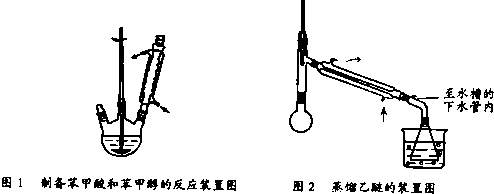
实验步骤如下:
①向图l 所示装置中加入8g氢氧化钠和30mL水,搅拌溶解.稍冷,加入10mL苯甲醛.开启搅拌器,调整转速,使搅拌平稳进行.加热回流约40min.
②停止加热,从球形冷凝管上口缓缓加入冷水20mL,摇动均匀,冷却至室温.反应物冷却至室温后,用乙醚萃取三次,每次
10mL.水层保留待用.合并三次萃取液,依次用5mL饱和亚硫酸氢钠溶液洗涤,10mL 10%碳酸钠溶液洗涤,10mL水洗涤,分液水层弃去所得醚层进行实验③.
③将分出的醚层,倒入干燥的锥形瓶,加无水硫酸镁,注意锥形瓶上要加塞.将锥形瓶中溶液转入图2 所示蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必需改变加热方式,升温至140℃时应对水冷凝管冷凝方法调整,继续升高温度并收集203℃~205℃的馏分得产品A.
④实验步骤②中保留待用水层慢慢地加入到盛有30mL浓盐酸和30mL水的混合物中,同时用玻璃棒搅拌,析出白色固体.冷却,抽滤,得到粗产品,然后提纯得产品B.
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需
(2)饱和亚硫酸氢钠溶液洗涤是为了除去
 .
.
(3)步骤③中无水硫酸镁是
(4)蒸馏除乙醚的过程中采用的加热方式为
(5)提纯产品B 所用到的实验操作为
查看习题详情和答案>>

已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃).
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸.
③石蜡油沸点高于250℃

实验步骤如下:
①向图l 所示装置中加入8g氢氧化钠和30mL水,搅拌溶解.稍冷,加入10mL苯甲醛.开启搅拌器,调整转速,使搅拌平稳进行.加热回流约40min.
②停止加热,从球形冷凝管上口缓缓加入冷水20mL,摇动均匀,冷却至室温.反应物冷却至室温后,用乙醚萃取三次,每次
10mL.水层保留待用.合并三次萃取液,依次用5mL饱和亚硫酸氢钠溶液洗涤,10mL 10%碳酸钠溶液洗涤,10mL水洗涤,分液水层弃去所得醚层进行实验③.
③将分出的醚层,倒入干燥的锥形瓶,加无水硫酸镁,注意锥形瓶上要加塞.将锥形瓶中溶液转入图2 所示蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必需改变加热方式,升温至140℃时应对水冷凝管冷凝方法调整,继续升高温度并收集203℃~205℃的馏分得产品A.
④实验步骤②中保留待用水层慢慢地加入到盛有30mL浓盐酸和30mL水的混合物中,同时用玻璃棒搅拌,析出白色固体.冷却,抽滤,得到粗产品,然后提纯得产品B.
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需
分液漏斗
分液漏斗
(仪器名称),实验前对该仪器进行检漏操作,方法是向分液漏斗加少量水,检查旋塞芯外是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水,待确认不漏水后方可使用
向分液漏斗加少量水,检查旋塞芯外是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水,待确认不漏水后方可使用
.(2)饱和亚硫酸氢钠溶液洗涤是为了除去
未反应完的苯甲醛
未反应完的苯甲醛
,而用碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸.醚层中少量的苯甲酸是从水层转移过来的,请用离子方程式说明其产生原因

(3)步骤③中无水硫酸镁是
干燥(吸收水分)
干燥(吸收水分)
剂;产品A为苯甲醇
苯甲醇
(4)蒸馏除乙醚的过程中采用的加热方式为
水浴加热
水浴加热
;蒸馏得产品A加热方式是石蜡油油浴加热
石蜡油油浴加热
;蒸馏温度高于140℃时应改用改用空气冷凝管
改用空气冷凝管
冷凝.(5)提纯产品B 所用到的实验操作为
重结晶
重结晶
.实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应式如下:

已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)
②乙醚沸点34.6℃,相对密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸.

实验步骤如下:
①向图1所示装置中加入8g氢氧化钠和30mL水,搅拌溶解.稍冷,加入10mL新蒸过的苯甲醛.开启搅拌器,调整转速,使搅拌平稳进行.加热回流约40min.
②停止加热,从球形冷凝管上口缓缓加入冷水20mL,摇动均匀,冷却至室温.反应物冷却至室温后,倒入分液漏斗,用乙醚萃取三次,每次10mL.水层保留待用.合并三次萃取液,依次用5mL饱和亚硫酸氢钠溶液洗涤,10mL 10%碳酸钠溶液洗涤,10mL水洗涤.
③分出醚层,倒入干燥的锥形瓶,加无水硫酸镁,注意锥形瓶上要加塞.将锥形瓶中溶液转入图2所示蒸馏装置,缓缓加热蒸馏除去乙醚.当温度升到140℃时改用空气冷凝管,收集198℃~204℃的馏分得产品A.将萃取后的水溶液慢慢地加入到盛有30mL浓盐酸和30mL水的混合物中,同时用玻璃棒搅拌,析出白色固体.冷却,过滤,得到粗产品,然后提纯得产品B.
根据以上步骤回答下列问题:
(1)步骤①中所加的苯甲醛为什么要是新蒸过的?
(2)步骤②萃取时用到的玻璃仪器有烧杯、
(3)步骤③中无水硫酸镁的作用是
(4)产品A为
查看习题详情和答案>>

已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)
②乙醚沸点34.6℃,相对密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸.

实验步骤如下:
①向图1所示装置中加入8g氢氧化钠和30mL水,搅拌溶解.稍冷,加入10mL新蒸过的苯甲醛.开启搅拌器,调整转速,使搅拌平稳进行.加热回流约40min.
②停止加热,从球形冷凝管上口缓缓加入冷水20mL,摇动均匀,冷却至室温.反应物冷却至室温后,倒入分液漏斗,用乙醚萃取三次,每次10mL.水层保留待用.合并三次萃取液,依次用5mL饱和亚硫酸氢钠溶液洗涤,10mL 10%碳酸钠溶液洗涤,10mL水洗涤.
③分出醚层,倒入干燥的锥形瓶,加无水硫酸镁,注意锥形瓶上要加塞.将锥形瓶中溶液转入图2所示蒸馏装置,缓缓加热蒸馏除去乙醚.当温度升到140℃时改用空气冷凝管,收集198℃~204℃的馏分得产品A.将萃取后的水溶液慢慢地加入到盛有30mL浓盐酸和30mL水的混合物中,同时用玻璃棒搅拌,析出白色固体.冷却,过滤,得到粗产品,然后提纯得产品B.
根据以上步骤回答下列问题:
(1)步骤①中所加的苯甲醛为什么要是新蒸过的?
保存时间较长的苯甲醛已部分氧化成苯甲酸会使苯甲醇的产量相对减少
保存时间较长的苯甲醛已部分氧化成苯甲酸会使苯甲醇的产量相对减少
.(2)步骤②萃取时用到的玻璃仪器有烧杯、
分液漏斗
分液漏斗
,饱和亚硫酸氢钠溶液洗涤是为了除去未反应完的苯甲醛,而碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸
醚层中极少量的苯甲酸
.(3)步骤③中无水硫酸镁的作用是
干燥剂
干燥剂
,将锥形瓶中溶液转入图2所示蒸馏装置时涉及的实验操作为过滤
过滤
.(4)产品A为
苯甲醇
苯甲醇
,蒸馏除去乙醚的过程中采用的加热方式为水浴加热
水浴加热
.提纯产品B所用到的实验操作为重结晶
重结晶
.实验室通常以环已醇为原料在浓硫酸作用下脱水来制备环己烯.
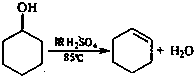
实验步骤下:
①在25mL干燥的圆底烧瓶中加入10g环己醇和0.5mL 98%浓硫酸,充分振荡.
②向烧瓶中放入2~3粒沸石,安装分馏装置,接收瓶用冰水冷却.
③小心加热,控制加热速度使温度不超过90℃,直到瓶底剩余少量残渣并出现白雾时停止加热.(已知:环己烯,沸点82.98℃;环己烯-10%水,沸点70.8℃;环己醇-80%水,沸点97.8℃:环己醇-30.5%环己烯,沸点64.9℃)
④向馏出液中加约1g精盐使其达饱和,然后加入2mL饱和碳酸钠水溶液,充分振荡.
⑤…
⑥有机层倒入干燥的小锥形瓶中,加入1~2g无水氯化钙干燥.待溶液清亮透明后过滤.
⑦将滤液移入圆底烧瓶中,加入2~3粒沸石,蒸馏.收集80~85℃馏分,称重约7.4g.
⑧计算.
请回答下列问题:
(1)步骤①中,加入10g环已醇和0.5mL 98%浓硫酸的顺序是 ;
(2)步骤③中,为便干控制加热温度,应该采取的加热方法是 ;
(3)步骤④中,向馏出液中加约1g精盐使其达饱和的目的是 ;
(4)步骤⑤的操作是 ;
(5)步骤⑧计算得到的环己烯的产率为 ;分析实制得的环己烯质量低于理论产量可能的原因是 .
查看习题详情和答案>>

实验步骤下:
①在25mL干燥的圆底烧瓶中加入10g环己醇和0.5mL 98%浓硫酸,充分振荡.
②向烧瓶中放入2~3粒沸石,安装分馏装置,接收瓶用冰水冷却.
③小心加热,控制加热速度使温度不超过90℃,直到瓶底剩余少量残渣并出现白雾时停止加热.(已知:环己烯,沸点82.98℃;环己烯-10%水,沸点70.8℃;环己醇-80%水,沸点97.8℃:环己醇-30.5%环己烯,沸点64.9℃)
④向馏出液中加约1g精盐使其达饱和,然后加入2mL饱和碳酸钠水溶液,充分振荡.
⑤…
⑥有机层倒入干燥的小锥形瓶中,加入1~2g无水氯化钙干燥.待溶液清亮透明后过滤.
⑦将滤液移入圆底烧瓶中,加入2~3粒沸石,蒸馏.收集80~85℃馏分,称重约7.4g.
⑧计算.
请回答下列问题:
(1)步骤①中,加入10g环已醇和0.5mL 98%浓硫酸的顺序是
(2)步骤③中,为便干控制加热温度,应该采取的加热方法是
(3)步骤④中,向馏出液中加约1g精盐使其达饱和的目的是
(4)步骤⑤的操作是
(5)步骤⑧计算得到的环己烯的产率为
实验室常用强氧化剂(如KMnO4、KClO3和MnO2等)氧化浓盐酸的方法来制备氯气.某研究性学习小组欲探究用Na2O2与浓盐酸反应制备并检验氯气.供选用的实验试剂:a.Na2O2、b.浓盐酸、c.碱石灰、d.NaOH溶液、e.淀粉-KI溶液、f.CaCO3、g.石蕊试液、h.饱和NaCl溶液,装置如图所示(部分导管、蒸馏水略):
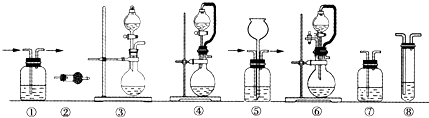
(1)写出用Na2O2与浓盐酸反应制备氯气的化学方程式: .
(2)下列装置组合最合理的是 (填序号,需考虑实验结束后拆卸装置时残留有害气体的处理).
(3)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为 .
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:① ,② .
(5)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一? (填“是”、“否”),理由是 .
查看习题详情和答案>>

(1)写出用Na2O2与浓盐酸反应制备氯气的化学方程式:
(2)下列装置组合最合理的是
| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③ | ① | ⑧/e | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/e | ① |
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:①
(5)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?