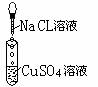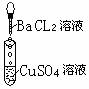摘要:为探究离子反应的实质.某同学设计了如下实验.有关的实验现象及反应方程式 列表如下.请补充完整: 编号 I II III 实验 现象 有白色沉淀生成.滤液为蓝色 有白色沉淀生成.滴加稀硝酸.沉淀不溶解 化学 方程式 2AgNO3+CuCL2== 2AgCL +Cu(NO3)2 离子 方程式 Ba2+ + SO42- == BaSO4
网址:http://m.1010jiajiao.com/timu3_id_199059[举报]
为探究离子反应的实质,某同学设计了如下实验,有关的实验现象及反应方程式
列表如下,请补充完整:
编号 | I | II | III |
实验 |
|
|
|
现象 | 有白色沉淀生成,滤液为蓝色 | 有白色沉淀生成,滴加稀硝酸,沉淀不溶解 | |
化学 方程式 |
| 2AgNO3+CuCl2==2AgCl | |
离子 方程式 |
| Ba2+ + SO42- == BaSO4 |
![]()
某同学设计了一套实验方案研究第11-18号部分元素的性质变化
(1)指出②中的实验现象:
(2)实验Ⅰ的设计中能达到实验目的实验项目是
(3)写出③中发生反应的离子方程式:
(4)④中密封油H2S的玻璃管加热后出现黄色固体,分析产生这种现象的原因是:
查看习题详情和答案>>
| 实验 | 实验目的 | 实验内容 |
| Ⅰ | 探究Mg、Al的金属性强弱 | 1将除去氧化膜的镁条和铝条分别投入稀盐酸中 2将除去氧化膜的镁条和铝条分别放入试管中,加入 少量水,加热至沸腾,再向溶液中滴加酚酞溶液 3向MgCl2和AlCl3溶液中分别加氨水至过量 |
| Ⅱ | 探究Cl、S的非金属性强弱 | ④分别加热密封于玻璃管中的H2S和HCl气体 |
镁条和铝条表面均有气泡产生,且溶液变红
镁条和铝条表面均有气泡产生,且溶液变红
(2)实验Ⅰ的设计中能达到实验目的实验项目是
①②
①②
(填序号)(3)写出③中发生反应的离子方程式:
Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+
Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+
、Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
(4)④中密封油H2S的玻璃管加热后出现黄色固体,分析产生这种现象的原因是:
H2S不稳定,加热分解成H2和S,S为黄色固体
H2S不稳定,加热分解成H2和S,S为黄色固体
.密封有HCl的玻璃管无明显现象.该实验说明非金属性:S弱于
弱于
Cl(填“强于”或“弱于”) 某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.
某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.请回答:
(1)用上述装置探究影响化学反应速率的因素.
①圆底烧瓶中发生反应的离子方程式是
Zn+2H+=Zn2++H2↑
Zn+2H+=Zn2++H2↑
.②用如图所示装置进行实验,以生成9.0mL气体为计时终点,结果为t1>t2.
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol?L-1 | t/s | Ⅰ | 40 | 1 | t1 | Ⅱ | 40 | 4 | t2 |
在其它条件一定时,化学反应速率随反应物浓度的增大而增大
在其它条件一定时,化学反应速率随反应物浓度的增大而增大
.③若将锌片换成含粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验的数据.粗锌片中所含杂质可能是(填序号)
abc
abc
. a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀.生铁放在烧瓶中,则
①圆底烧瓶中的试剂可选用(填序号)
ac
ac
.a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是
量气管右端液面下降,左端液面上升
量气管右端液面下降,左端液面上升
. 某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.请回答:
某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.请回答:(1)用上述装置探究影响化学反应速率的因素.
①圆底烧瓶中发生反应的离子方程式是
Zn+2H+=Zn2++H2↑
Zn+2H+=Zn2++H2↑
.②用上述装置进行实验,以生成9.0mL气体为计时终点,结果为t1>t2.
| 序号 | V(H2SO4)/mL | C(H2SO4)/mol?L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 4 | t2 |
在其它条件一定时,化学反应速率随反应物浓度的增大而增大
在其它条件一定时,化学反应速率随反应物浓度的增大而增大
.实验过程中,对量气管的操作是
调整量气管,使其左右管中水面始终持平
调整量气管,使其左右管中水面始终持平
.③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是(填序号)
abc
abc
.A.石墨 b.银 c.铜d.沙粒(二氧化硅)
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀.
①圆底烧瓶中的试剂可选用(填序号)
ac
ac
.a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是
量气管右端液面下降,左端液面上升
量气管右端液面下降,左端液面上升
.某同学设计下图装置进行铁和浓H2SO4反应的实验探究,请回答下列问题.
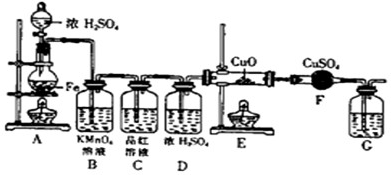
(1)将16克铁粉放入烧瓶中,由分液漏斗放入20mL 18mol/L的浓H2SO4,结果没有任何反应现象,原因是
(2)随着反应的进行,B中酸性KMnO4溶液颜色逐渐变浅(产物中有Mn2+),请用离子方程式表示:
(3)当G处有持续稳定的气泡时,再点燃E处酒精灯,这样操作的原因是
(4)反应一段时间后,E、F处可观察到明显的现象,F处的实验现象
(5)为了确保实验的严谨性和F中现象的可信性,通常在F装置后再接一个装置G,则G中盛放的液体可以是
A.CaCl2溶液 B.Ca(OH)2溶液 C.浓硫酸 D.CCl4
(6)将a mol Fe与含b mol H2SO4的浓硫酸共热,假设按本题的过程进行反应,如果Fe与H2SO4均恰好完全反应,则生成的有
气体1是
气体2是
查看习题详情和答案>>

(1)将16克铁粉放入烧瓶中,由分液漏斗放入20mL 18mol/L的浓H2SO4,结果没有任何反应现象,原因是
铁在冷的浓硫酸中钝化
铁在冷的浓硫酸中钝化
.随后点燃A处酒精灯,就有气体产生了.(2)随着反应的进行,B中酸性KMnO4溶液颜色逐渐变浅(产物中有Mn2+),请用离子方程式表示:
2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
,C中品红溶液颜色始终没有变化.(3)当G处有持续稳定的气泡时,再点燃E处酒精灯,这样操作的原因是
待反应产生的H2将装置中的空气排尽再加热,防止H2与空气混合加热爆炸
待反应产生的H2将装置中的空气排尽再加热,防止H2与空气混合加热爆炸
.(4)反应一段时间后,E、F处可观察到明显的现象,F处的实验现象
白色粉末变为蓝色
白色粉末变为蓝色
.(5)为了确保实验的严谨性和F中现象的可信性,通常在F装置后再接一个装置G,则G中盛放的液体可以是
CD
CD
A.CaCl2溶液 B.Ca(OH)2溶液 C.浓硫酸 D.CCl4
(6)将a mol Fe与含b mol H2SO4的浓硫酸共热,假设按本题的过程进行反应,如果Fe与H2SO4均恰好完全反应,则生成的有
气体1是
H2
H2
,其物质的量为(2a-b)
(2a-b)
mol,气体2是
SO2
SO2
,其物质的量为(b-a)
(b-a)
mol.