摘要: 3 化学中常用的物理量-物理的量同步训练题 创新测试:
网址:http://m.1010jiajiao.com/timu3_id_198597[举报]
化学变化中既有物质变化,也有能量变化,研究化学反应有利于指导工业生产.下列是常见的化学反应:①电解熔融氯化钠 ②氮气与氢气合成氨气 ③锌与稀硫酸反应 ④煅烧石灰石.
(1)从不同角度可以对上述反应进行分类:从反应前后能量变化角度看上述反应属于放热反应的是
(2)反应③在实验室中用于制备氢气,要提高生成氢气的速率下列措施合理的是
a.加入硝酸,增大氢离子的浓度 b.用浓硫酸代替稀硫酸
c.加入少量铜粉 d.将稀硫酸的体积加倍.
反应③可以设计成原电池反应,其中负极上反应的物质是
(3)反应②是可逆反应,常应用于工业生产,升高温度正反应速率
查看习题详情和答案>>
(1)从不同角度可以对上述反应进行分类:从反应前后能量变化角度看上述反应属于放热反应的是
②③
②③
(填序号,下同);从有无电子转移角度看上述反应属于非氧化还原反应的是④
④
;从反应前后物质种类的变化角度看,①和④均属于分解
分解
反应;①和②在变化过程中断裂的化学键类型分别为离子键
离子键
、共价键
共价键
.(2)反应③在实验室中用于制备氢气,要提高生成氢气的速率下列措施合理的是
c
c
.a.加入硝酸,增大氢离子的浓度 b.用浓硫酸代替稀硫酸
c.加入少量铜粉 d.将稀硫酸的体积加倍.
反应③可以设计成原电池反应,其中负极上反应的物质是
锌
锌
,电子流向正
正
极.(3)反应②是可逆反应,常应用于工业生产,升高温度正反应速率
增大
增大
(填“增大”、“减小”或“不变”,下同),逆反应速率增大
增大
;请列举一项该反应达到平衡的标志正反应速率等于逆反应速率
正反应速率等于逆反应速率
.物质的量是高中化学中常用的物理量,请完成以下有关其计算的内容.
(1)0.2g H2含有
(2)标准状况下,含有相同氧原子数的CO与CO2的体积之比为
(3)100mL 某Al2(SO4)3溶液中,c(Al3+)=2.0mol/L,则其中c(SO42-)=
(4)4.8g Mg与足量的CO2完全反应,所得产物中黑色固体的物质的量为
查看习题详情和答案>>
(1)0.2g H2含有
1.204×1023
1.204×1023
个H原子.(2)标准状况下,含有相同氧原子数的CO与CO2的体积之比为
2:1
2:1
.(3)100mL 某Al2(SO4)3溶液中,c(Al3+)=2.0mol/L,则其中c(SO42-)=
3.0
3.0
mol/L.(4)4.8g Mg与足量的CO2完全反应,所得产物中黑色固体的物质的量为
0.1
0.1
mol.[化学-选修化学与技术]金属钛(Tl)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”.常温下,钛的化学活性很小,仅能与氧气、氢氟酸等几种物质起反应.但在较高温度下,钛可与多种单质和化合物发生反应.以钛铁矿(主要成分FeTlO2,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:
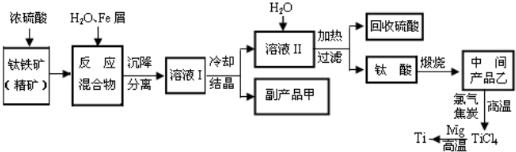
请回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TlOSO4,无气体生成,副产品甲是 .
(2)上述生产流程中加入Fe的目的是 ,检验副产品甲是否变质的实验方法是 .
(3)上述生产流程中所得一的金属钛中混有少量杂质,可加入 溶解后除去.
(4)科学家从电解冶炼铝的工艺得到启发,找到了冶炼钛的新工艺,它可以用熔融法直接电解中间产品乙制取金属法.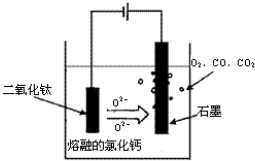
①直接电解法(剑桥法)生产钛是种较先进的方法,电解质为熔融的氧化钙,原理如图所示;在阴极,被还原的Ca进一步还原TlO2获得钛,可能发生的反应或电极反应为 .
②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两 极产物隔开,只允许氧离子通过,在电解过程中阳极通入某种还原性气体,可防止CO、CO2污染物产生,通入的气体若是单质,可以是 ,则阳极发生的电极反应式为 .
查看习题详情和答案>>

请回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TlOSO4,无气体生成,副产品甲是
(2)上述生产流程中加入Fe的目的是
(3)上述生产流程中所得一的金属钛中混有少量杂质,可加入
(4)科学家从电解冶炼铝的工艺得到启发,找到了冶炼钛的新工艺,它可以用熔融法直接电解中间产品乙制取金属法.

①直接电解法(剑桥法)生产钛是种较先进的方法,电解质为熔融的氧化钙,原理如图所示;在阴极,被还原的Ca进一步还原TlO2获得钛,可能发生的反应或电极反应为
②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两 极产物隔开,只允许氧离子通过,在电解过程中阳极通入某种还原性气体,可防止CO、CO2污染物产生,通入的气体若是单质,可以是
[化学--选修2:化学与技术]
工业上通常采用碱法从铝土矿制取Al2O3,如图为碱法制取Al2O3的工艺流程.已知铝土矿中含有的杂质主要是氧化铁、含硅化合物.
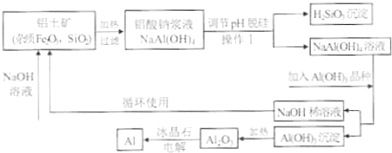
回答下列问题:
(1)操作I的名称是 ;得到的H2SiO3沉淀经过处理可得到硅胶,写出硅胶的一种用途 .
(2)工业上将Al2O3投入熔融的冰晶石,通过电解制备金属铝,冰晶石的作用是 .铝电解槽的阳极材料为碳块,需要定期更换,说明原因 .
(3)工业上用NaOH溶液溶解铝上矿,是利用了Al2O3的 性.
(4)写出铝土矿中杂质与加入的氢氧化钠溶液反应的离子方程式 .
(5)往铝酸钠[NaAl(OH)4]溶液中加入晶种Al(OH)3,通过结晶析出氢氧化铝,写出析出氢氧化铝的离子方程式 .
(6)氢氧化铝在不同温度下分解产物不同,已知:
2Al(OH)3
Al2O3?H2O+2H2O↑ Al2O3?H2O
Al2O3+H2O↑
现有一定温度下加热氢氧化铝得到的固体产物,经测定其中氢元素含量为1.0%,判断固体产物的成分是 .
查看习题详情和答案>>
工业上通常采用碱法从铝土矿制取Al2O3,如图为碱法制取Al2O3的工艺流程.已知铝土矿中含有的杂质主要是氧化铁、含硅化合物.

回答下列问题:
(1)操作I的名称是
(2)工业上将Al2O3投入熔融的冰晶石,通过电解制备金属铝,冰晶石的作用是
(3)工业上用NaOH溶液溶解铝上矿,是利用了Al2O3的
(4)写出铝土矿中杂质与加入的氢氧化钠溶液反应的离子方程式
(5)往铝酸钠[NaAl(OH)4]溶液中加入晶种Al(OH)3,通过结晶析出氢氧化铝,写出析出氢氧化铝的离子方程式
(6)氢氧化铝在不同温度下分解产物不同,已知:
2Al(OH)3
| ||
| ||
现有一定温度下加热氢氧化铝得到的固体产物,经测定其中氢元素含量为1.0%,判断固体产物的成分是
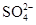 )= ______mol/L。
)= ______mol/L。