网址:http://m.1010jiajiao.com/timu3_id_198327[举报]
A.在托盘天平上称量出8.0gNaOH固体;
B.用少量蒸馏水洗涤盛放溶液的容器和玻璃棒2~3次,并将洗涤液全部移到容量瓶中,轻轻摇动容量瓶,使溶液混合均匀;
C.把称好的NaOH固体加入40mL蒸馏水,用玻璃棒搅拌,使NaOH固体完全溶解,待
D.将蒸馏水加入容量瓶至液面接近刻度1cm~2cm处;
E.盖好容量瓶瓶塞,反复颠倒、摇匀;
F.用胶头滴管向容量瓶里逐滴加水,使溶液凹液面恰好与刻度线相切;
G.将配制好的溶液倒入试剂瓶中,贴好标签.
回答下列问题:
(1)填写C步骤作叙述中的空白处.
(2)正确的操作顺序是(用字母A、B、C…表示):
(3)称量NaOH固体时,应将NaOH固体放在
(4)该实验中的容量瓶
(5)在上述F步操作中,俯视读数会导致溶液浓度偏
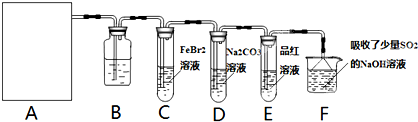
(1)若A是用二氧化锰和浓盐酸反应制取氯气的发生装置,除圆底烧瓶和导管外还用到的玻璃仪器有
(2)①装置B中盛有的试剂是
②若E中品红溶液褪色,则C装置中发生反应的离子方程式是
③已知碳酸的酸性强于次氯酸,则装置D中反应的化学方程式为
(3)某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气.吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解;在碱性条件下ClO-也有强氧化性.).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既存在SO32-,也存在ClO-;
假设4:既不存在SO32-,也不存在ClO-.
指导老师经分析认为,其中一个假设并不合理,它是
②设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.限选实验试剂.
a.3mol/L H2SO4 b.0.01mol/L KMnO4 c.1mol/L BaCl2溶液
d.淀粉一KI溶液 e.酚酞试液 f.品红溶液
步骤一;取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加1~2滴
步骤三:向B试管中滴加1~2滴
③若假设2成立;写出步骤三中的离子方程式:
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
23.铝原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。
24.镓(Ga)与铝同族。写出镓的氯化物和氨水反应的化学方程式。
25.硅与铝同周期。SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 。
长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为
26.用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO![]() 3Ba↑+BaO·Al2O3
3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性 (选填“强”“弱”)。利用上述方法可制取Ba的主要原因是 。
a.高温时Al的活泼性大于Ba b.高温有利于BaO分解
c.高温时BaO·Al2O3比Al2O3稳定 d.Ba的沸点比Al的低
查看习题详情和答案>>(1)铝原子核外电子云有
(2)镓(Ga)与铝同族.写出镓的氯化物和氨水反应的化学方程式
(3)硅与铝同周期.SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O?CaO?6SiO2.盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式
(4)用铝和金属氧化物反应制备金属单质是工业上较常用的方法.如:2Al+4BaO
| 高温 |
a.高温时Al的活泼性大于Ba b.高温有利于BaO分解
c.高温时BaO?Al2O3比Al2O3稳定 d.Ba的沸点比Al的低.
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
(1)铝原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。
(2)镓(Ga)与铝同族。写出镓的氯化物和氨水反应的化学方程式。
(3)硅与铝同周期。SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 。
长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为
(4)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO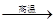 3Ba↑+BaO·Al2O3
3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性 (选填“强”“弱”)。利用上述方法可制取Ba的主要原因是 。
a.高温时Al的活泼性大于Ba b.高温有利于BaO分解
c.高温时BaO·Al2O3比Al2O3稳定 d.Ba的沸点比Al的低