网址:http://m.1010jiajiao.com/timu3_id_198167[举报]
“化学是人类进步的关键”。下列说法不正确的是 ( )
| A.PM2.5是指空气中直径≤2.5 μm的固体颗粒或液滴的总称 |
| B.根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间 |
| C.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素 |
D.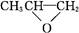 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物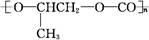 ,该反应符合绿色化学的原则 ,该反应符合绿色化学的原则 |
(1)无机非金属材料.单晶硅是一种比较活泼的非金属元素,是晶体材料的重要组成部分,处于新材料发展的前沿.其主要用途是用做半导体材料和利用太阳能光伏发电、供热等.单晶硅的制备方法如下:
SiO2
| ①C |
| 高温 |
| ②HCI |
| 300℃ |
| ③过量H2 |
| 1000~1100℃ |
①写出步骤①的化学方程式:
②已知以下几种物质的沸点:
| 物质 | SiHCl3 | SiCl4 | HCl |
| 沸点 | 33.0℃ | 57.6℃ | -84.7℃ |
(2)金属材料.金属材料是指金属元素或以金属元素为主构成的具有金属特性的材料的统称.包括纯金属、合金和特种金属材料等.
①下列物质中不属于合金的是
②铜器制品常因接触空气中的O2、CO2和H2O而易生成铜锈.试写出保护铜制品的方法:
(3)纳米材料,胶体粒子的直径大约是
(4)磁性材料.某磁性粉末材料是一种复合型氧化物,为测定其组成,现称取6.26g样品,将其全部溶于过量稀HNO3,加入过量Na2SO4溶液,生成4.66g白色沉淀、过滤、在滤液中加入过量NaOH溶液,生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20g固体.
①该磁性粉末中氧元素的质量分数为
②该材料的化学式为
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中—题,并在相应的答题区域作答。若两题都做,则按A题评分。
A.镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)请参考下述数据填空和回答问题:

工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。不用电解MgO的方法生产镁的原因 ;不用电解AlCl3的方法生产铝的原因 。
(2)2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为 。

(3)写出Cu+的核外电子排布式 。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
(5)某喹喏酮类药物(中心离子是Cu2+)结构如下图,关于该药物的说法正确的是 。

A.中心离子Cu2+的配位数是5
B.N原子均采用sp2杂化
C.存在配位键、极性共价键和非极性共价键
D.熔点很高,硬度很大
B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4 g花生油样品,置于两个干燥的碘瓶(如图)内,加入10 mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00 mL含0.01 mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。

步骤II:在暗处放置30 min,并不时轻轻摇动。30 min后,小心地打开玻璃塞,用新配制的10%
碘化钾10 mL和蒸馏水50 mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1 mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
①
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是 ,碘瓶不干燥会发生反应的化学方程式 。
(2)步骤Ⅱ中碘瓶在暗处放置30 min,并不时轻轻摇动的原因是 。
(3)步骤Ⅲ中所加指示剂为 ,滴定终点的现象 。
(4)反应结束后从液体混合物中回收四氯化碳,所需操作有 。
查看习题详情和答案>>