摘要:21.含镁3%-5%的镁铝合金.现已成为轮船制造.化工生产.机械制造等行业的重要材料.现有一块已知质量为56.4g的镁铝合金.欲测定其中镁的质量分数.两位同学设计了不同的实验方案. 实验设计Ⅰ: 镁铝合金 溶液 过滤.得到沉淀质量为5.8g 实验设计Ⅱ:-- 请回答以下问题: (1)写出实验设计Ⅰ中反应①的离子方程式 , . (2)依据实验设计Ⅰ.求出镁的质量分数. (3)请你为另一位同学设计第Ⅱ种测定镁的质量分数的方案. 永安一中2008-2009学年下学期第一次月考
网址:http://m.1010jiajiao.com/timu3_id_198143[举报]
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验设计1:
镁铝合金
溶液
得到沉淀的质量为m2g;
实验设计2:
镁铝合金
生成的气体在标准状况下的体积为V1L.
实验设计3:
镁铝合金
生成的气体在标准状况下的体积为V2L.
请回答以下问题:
(1)写出实验设计1中单质铝发生反应的离子方程式:
(2)写出实验设计2中反应的离子方程式:
(3)判断这几种实验设计能否求出镁的质量分数,能求出的用题目提供的数据将镁的质量分数表示出来,不能求出的就空着不填.
①实验设计1
×100%
×100%
②实验设计2
③实验设计3
×100%
×100%.
查看习题详情和答案>>
实验设计1:
镁铝合金
| ①足量盐酸 |
| ②过量NaOH溶液 |
| 过滤 |
实验设计2:
镁铝合金
| 足量的NaOH溶液 |
实验设计3:
镁铝合金
| 足量盐酸 |
请回答以下问题:
(1)写出实验设计1中单质铝发生反应的离子方程式:
2Al+6H+═2Al3++3H2↑?、Al3++4OH-═[Al(OH)4]-或Al3++3OH-═Al(OH)3↓?Al(OH)3+OH-═[Al(OH)4]-?
2Al+6H+═2Al3++3H2↑?、Al3++4OH-═[Al(OH)4]-或Al3++3OH-═Al(OH)3↓?Al(OH)3+OH-═[Al(OH)4]-?
(2)写出实验设计2中反应的离子方程式:
2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑
2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑
(3)判断这几种实验设计能否求出镁的质量分数,能求出的用题目提供的数据将镁的质量分数表示出来,不能求出的就空着不填.
①实验设计1
| 24m1 |
| 58m2 |
| 24m1 |
| 58m2 |
②实验设计2
(1-
)×100%
| 9V1 |
| 11.2m1 |
(1-
)×100%
| 9V1 |
| 11.2m1 |
③实验设计3
| 44.8m1-36V2 |
| 11.2m1 |
| 44.8m1-36V2 |
| 11.2m1 |
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要材料.现有一块已知质量为56.4g的镁铝合金,欲测定其中镁的质量分数,两位同学设计了不同的实验方案.
实验设计Ⅰ:
镁铝合金
溶液
过滤,得到沉淀质量为5.8g
实验设计Ⅱ:…
请回答以下问题:
(1)写出实验设计Ⅰ中反应①的离子方程式
(2)依据实验设计Ⅰ,求出镁的质量分数.(要求写计算过程)
(3)请你为另一位同学设计第Ⅱ种测定镁的质量分数的方案.(写出必要的实验过程)
查看习题详情和答案>>
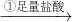
实验设计Ⅰ:
镁铝合金
| ①足量盐酸 |
| ②过量NaOH溶液 |
实验设计Ⅱ:…
请回答以下问题:
(1)写出实验设计Ⅰ中反应①的离子方程式
Mg+2H+=Mg2++H2↑
Mg+2H+=Mg2++H2↑
;2A1+6H+=2A13++3H2↑
2A1+6H+=2A13++3H2↑
.(2)依据实验设计Ⅰ,求出镁的质量分数.(要求写计算过程)
(3)请你为另一位同学设计第Ⅱ种测定镁的质量分数的方案.(写出必要的实验过程)
 溶液
溶液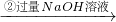 过滤,得到沉淀质量为5.8g
过滤,得到沉淀质量为5.8g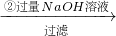 得到沉淀的质量为m2g;
得到沉淀的质量为m2g;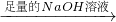 生成的气体在标准状况下的体积为V1L.
生成的气体在标准状况下的体积为V1L. 生成的气体在标准状况下的体积为V2L.
生成的气体在标准状况下的体积为V2L.