摘要:25.某实验小组为测定大理石中碳酸钙的质量分数.利用一定质量的大理石与足量盐酸反应生成CO2的质量来进行分析测定. (1)仪器①的名称是 .装置A中反应的化学方程式为 . (2)装置C用于干燥产生的CO2.请你在虚线方框内将导管补充完整(图中“→ 表示气体流向). (3)将上图装置连接成整套实验.则装置按字母连接的顺序为 → → → . (4)装置B中反应的化学方程式为 . (5)实验中参加反应的大理石质量为10 g.装置B反应前后的质量差为3.52 g.则大理石的中碳酸钙的质量分数为 .
网址:http://m.1010jiajiao.com/timu3_id_19740[举报]
某实验小组为测定大理石中碳酸钙的质量分数,利用一定质量的大理石与足量盐酸反应生成CO2的质量来进行分析测定.
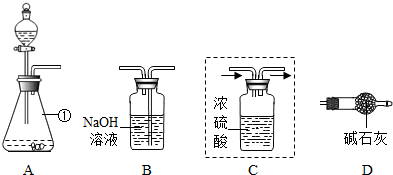
(1)仪器①的名称是 ,装置A中反应的化学方程式为 .
(2)装置C用于干燥产生的CO2,请你在虚线方框内将导管补充完整(图中“→”表示气体流向).
(3)将上图装置连接成整套实验,则装置按字母连接的顺序为 → → → .
(4)装置B中反应的化学方程式为 .
(5)实验中参加反应的大理石质量为10g,装置B反应前后的质量差为3.52g,则大理石的中碳酸钙的质量分数为 (写计算结果).
查看习题详情和答案>>

(1)仪器①的名称是
(2)装置C用于干燥产生的CO2,请你在虚线方框内将导管补充完整(图中“→”表示气体流向).
(3)将上图装置连接成整套实验,则装置按字母连接的顺序为
(4)装置B中反应的化学方程式为
(5)实验中参加反应的大理石质量为10g,装置B反应前后的质量差为3.52g,则大理石的中碳酸钙的质量分数为
某实验小组为测定大理石中碳酸钙的质量分数,利用一定质量的大理石与足量盐酸反应生成CO2的质量来进行分析测定.
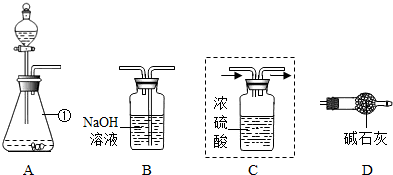
(1)仪器①的名称是________,装置A中反应的化学方程式为________.
(2)装置C用于干燥产生的CO2,请你在虚线方框内将导管补充完整(图中“→”表示气体流向).
(3)将上图装置连接成整套实验,则装置按字母连接的顺序为________→________→________→________.
(4)装置B中反应的化学方程式为________.
(5)实验中参加反应的大理石质量为10g,装置B反应前后的质量差为3.52g,则大理石的中碳酸钙的质量分数为________(写计算结果).
查看习题详情和答案>>
某实验小组为测定大理石中碳酸钙的质量分数,利用一定质量的大理石与足量盐酸反应生成CO2的质量来进行分析测定。

(1)仪器①的名称是 ,装置A中反应的化学方程式为 。
(2)装置C用于干燥产生的CO2,请你在虚线方框内将导管补充完整(图中“→”表示气体流向)。
(3)将上图装置连接成整套实验,则装置按字母连接的顺序为 → → → 。
(4)装置B中反应的化学方程式为 。
(5)实验中参加反应的大理石质量为10g,装置B反应前后的质量差为3.52g,则大理石的中碳酸钙的质量分数为 (写计算结果)。
查看习题详情和答案>>
(2)装置C用于干燥产生的CO2,请你在虚线方框内将导管补充完整(图中“→”表示气体流向)。
(3)将上图装置连接成整套实验,则装置按字母连接的顺序为 → → → 。
(4)装置B中反应的化学方程式为 。
(5)实验中参加反应的大理石质量为10g,装置B反应前后的质量差为3.52g,则大理石的中碳酸钙的质量分数为 (写计算结果)。
某实验小组为测定大理石中碳酸钙的质量分数,利用一定质量的大理石与足量盐酸反应生成CO2的质量来进行分析测定.
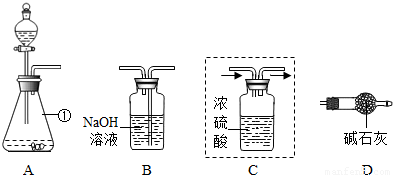
(1)仪器①的名称是______,装置A中反应的化学方程式为______.
(2)装置C用于干燥产生的CO2,请你在虚线方框内将导管补充完整(图中“→”表示气体流向).
(3)将上图装置连接成整套实验,则装置按字母连接的顺序为______→______→______→______.
(4)装置B中反应的化学方程式为______.
(5)实验中参加反应的大理石质量为10g,装置B反应前后的质量差为3.52g,则大理石的中碳酸钙的质量分数为______(写计算结果).
查看习题详情和答案>>

(1)仪器①的名称是______,装置A中反应的化学方程式为______.
(2)装置C用于干燥产生的CO2,请你在虚线方框内将导管补充完整(图中“→”表示气体流向).
(3)将上图装置连接成整套实验,则装置按字母连接的顺序为______→______→______→______.
(4)装置B中反应的化学方程式为______.
(5)实验中参加反应的大理石质量为10g,装置B反应前后的质量差为3.52g,则大理石的中碳酸钙的质量分数为______(写计算结果).
查看习题详情和答案>>
某实验小组对实验室制二氧化碳反应速率的影响因素以及反应后的产物进行了探究:
Ⅰ探究影响反应速率的因素:实验所用的试剂和反应条件如下:
实验小组设计的实验方案部分如下表,请根据信息帮助把表格空缺填写完整.
Ⅱ对反应后废液成分的探究:
为检验溶液中盐酸的存在,实验小组同学准备采用三个方案进行检验,请判断这些方案是否合理并写出理由:
实验证明,该废液中含盐酸.
Ⅲ反应后溶液中氯化钙的质量测定:
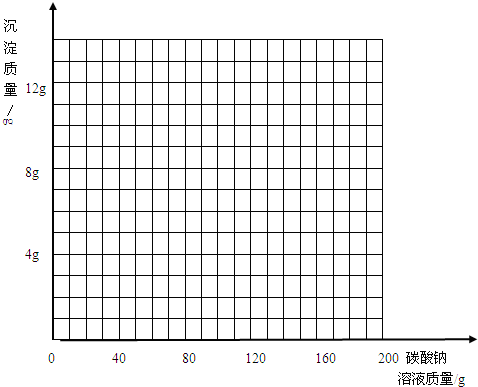
烧杯中装有一定量的反应废液,已探究得知该废液为氯化钙和盐酸的混合溶液,其中含氯化氢3.65g.实验小组为了测定混合溶液中氯化钙的质量,向烧杯中逐滴加入10.6%的碳酸钠溶液,得到沉淀的质量记录如下:
(1)得到沉淀的总质量为 g,该混合液中氯化钙的质量为 g.
(2)参加反应的碳酸钠溶液的总质量是多少克?写出计算过程.
(3)写出在该混合溶液中加入碳酸钠溶液的质量与生成沉淀质量变化关系的曲线.
 查看习题详情和答案>>
查看习题详情和答案>>
Ⅰ探究影响反应速率的因素:实验所用的试剂和反应条件如下:

实验小组设计的实验方案部分如下表,请根据信息帮助把表格空缺填写完整.
| 实验编号 | 温度 | 大理石 | 盐酸浓度 | 实验探究目的 |
| ① | 20℃ | 粗颗粒 | 5% | ⅰ实验①和②探究浓度对反应快慢的影响. ⅱ实验②和 ⅲ实验①和③探究大理石粗细对反应快慢的影响. |
| ② | 20℃ | 粗颗粒 | ||
| ③ | 细颗粒 | 5% | ||
| ④ | 40℃ | 10% |
为检验溶液中盐酸的存在,实验小组同学准备采用三个方案进行检验,请判断这些方案是否合理并写出理由:
| 方案 | 填是否合理 | 说明理由(写化学方程式) |
| 测溶液的pH是否小于7 | 合理 | 氯化钙是中性溶液,而盐酸呈酸性. |
| 滴加硝酸银溶液观察是否有白色沉淀生成 | ||
| 加铁粉观察是否有气泡 |
Ⅲ反应后溶液中氯化钙的质量测定:
烧杯中装有一定量的反应废液,已探究得知该废液为氯化钙和盐酸的混合溶液,其中含氯化氢3.65g.实验小组为了测定混合溶液中氯化钙的质量,向烧杯中逐滴加入10.6%的碳酸钠溶液,得到沉淀的质量记录如下:
| 加入碳酸钠溶液的质量/g | 40.0 | 80.0 | 120.0 | 160.0 | 200.0 |
| 生成沉淀的质量/g | 0.0 | 3.0 | 7.0 | 10.0 | 10.0 |
(2)参加反应的碳酸钠溶液的总质量是多少克?写出计算过程.
(3)写出在该混合溶液中加入碳酸钠溶液的质量与生成沉淀质量变化关系的曲线.
 查看习题详情和答案>>
查看习题详情和答案>>