题目内容
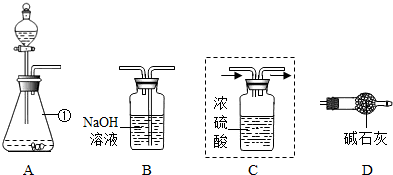
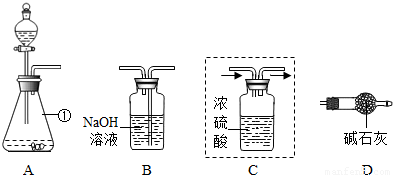
某实验小组为测定大理石中碳酸钙的质量分数,利用一定质量的大理石与足量盐酸反应生成CO2的质量来进行分析测定.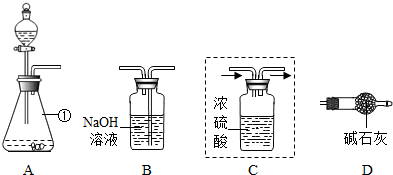
(1)仪器①的名称是
(2)装置C用于干燥产生的CO2,请你在虚线方框内将导管补充完整(图中“→”表示气体流向).
(3)将上图装置连接成整套实验,则装置按字母连接的顺序为
(4)装置B中反应的化学方程式为
(5)实验中参加反应的大理石质量为10g,装置B反应前后的质量差为3.52g,则大理石的中碳酸钙的质量分数为
分析:根据题意:测定大理石中碳酸钙的质量分数时利用一定质量的大理石与足量盐酸反应生成CO2的质量来进行分析测定,要测出生成的二氧化碳的量,而生成的二氧化碳中混有水,空气中也有水蒸气和二氧化碳,故要除去产物中的水,又要防止空气进入装置,导致误差.水可用浓硫酸吸收,二氧化碳能与碱反应,碱液中增加的质量即为二氧化碳的质量;最后使用干燥管防止空气进入装置.
解答:解:(1)A中为大理石与稀盐酸反应,答案为:锥形瓶;CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)洗气瓶使用时,长管进气体,短管出气体.故答案为: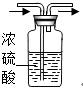
(3)整套装置要使大理石与酸反应制得二氧化碳,能测出纯净二氧化碳的质量,还要防止误差的产生,故答案为:A→C→B→D
(4)B中氢氧化钠吸收二氧化碳,故答案为:2NaOH+CO2=Na2CO3+H2O
(5)B中增加的质量即为二氧化碳的质量,根据反应的物质的质量之比等于反应系数之比,设碳酸钙的质量为xg,
解题如下:
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
xg 3.52g
=
解得:x=8
用公式:物质的质量分数=
*100%
故碳酸钙的质量分数为:
×100%=80%
(2)洗气瓶使用时,长管进气体,短管出气体.故答案为:

(3)整套装置要使大理石与酸反应制得二氧化碳,能测出纯净二氧化碳的质量,还要防止误差的产生,故答案为:A→C→B→D
(4)B中氢氧化钠吸收二氧化碳,故答案为:2NaOH+CO2=Na2CO3+H2O
(5)B中增加的质量即为二氧化碳的质量,根据反应的物质的质量之比等于反应系数之比,设碳酸钙的质量为xg,
解题如下:
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
xg 3.52g
| 100 |
| 44 |
| xg |
| 3.52g |
解得:x=8
用公式:物质的质量分数=
| 该物质的质量 |
| 混合物总质量 |
故碳酸钙的质量分数为:
| 8g |
| 10g |
点评:本题考查了大理石与酸的反应原理以及对大理石中碳酸钙含量的实验测定和求算,实验设计对学生的能力要求很高.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
 某实验小组为测定化学反应中能量的变化,设计如图实验.将活塞打开,水进入试管内,然后关闭活塞(忽略水对试管内气体体积的影响),整个实验过程可能出现的现象是
某实验小组为测定化学反应中能量的变化,设计如图实验.将活塞打开,水进入试管内,然后关闭活塞(忽略水对试管内气体体积的影响),整个实验过程可能出现的现象是