摘要: 已知化学反应N2+3H22NH3的能量变化如图所示. (1)1mol N 和3mol H 生成1mol NH3(g)是 能量的过程. (2)N2(g)+H2(g) NH3(g ) △H= , (3)N2(g)和H2生成NH3(1)的热化学方程式为
网址:http://m.1010jiajiao.com/timu3_id_197102[举报]
已知化学反应N2+3H2 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
(1)1mol N 和3mol H 生成1mol NH3(g)是 能量的过程(填“吸收”或“释放”)。
(2) N2(g)+
N2(g)+ H2(g)
H2(g)  NH3(g ) △H= ;
NH3(g ) △H= ;
(3)N2(g)和H2生成NH3(1)的热化学方程式为
已知化学反应N2+3H2 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,

(1)1mol N 和3mol H 生成1mol NH3(g)是 能量的过程(填“吸收”或“释放”)。
(2) N2(g)+
N2(g)+ H2(g)
H2(g)  NH3(g ) △H= ;
NH3(g ) △H= ;
(3)N2(g)和H2生成NH3(1)的热化学方程式为
查看习题详情和答案>>
已知化学反应N2+3H2![]() 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
(1)1mol N 和3mol H 生成1mol NH3(g)是 能量的过程(填“吸收”或“释放”)。
(2)![]() N2(g)+
N2(g)+![]() H2(g)
H2(g) ![]() NH3(g); △H = ;
NH3(g); △H = ;
(3)N2(g)和H2生成NH3(1)的热化学方程式为
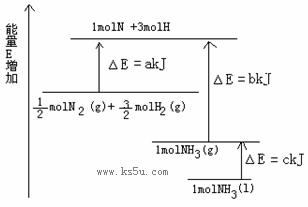
已知化学反应N2+3H2 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,

(1)1mol N 和3mol H 生成1mol NH3(g)是 能量的过程(填“吸收”或“释放”)。
(2) N2(g)+
N2(g)+ H2(g)
H2(g)  NH3(g ) △H= ;
NH3(g ) △H= ;
(3)N2(g)和H2生成NH3(1)的热化学方程式为
 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
(1)1mol N 和3mol H 生成1mol NH3(g)是 能量的过程(填“吸收”或“释放”)。
(2)
 N2(g)+
N2(g)+ H2(g)
H2(g)  NH3(g ) △H= ;
NH3(g ) △H= ;(3)N2(g)和H2生成NH3(1)的热化学方程式为
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;

请完成下列填空:
(1)H的化学式
(2)A与B 在加热条件下反应的主要现象是
(3)某温度时,在2L容器中,D、E、J三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为
查看习题详情和答案>>

请完成下列填空:
(1)H的化学式
NH4Cl
NH4Cl
;其晶体中所含化学键类型为离子键、共价键
离子键、共价键
;检验H 中阳离子的方法是取少量H样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子
取少量H样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子
.(2)A与B 在加热条件下反应的主要现象是
剧烈反应,火焰为黄色,生成淡黄色的固体
剧烈反应,火焰为黄色,生成淡黄色的固体
;F和H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
;写出G溶液中加入过量的I溶液反应的离子方程式CO32-+2H+=CO2↑+H2O
CO32-+2H+=CO2↑+H2O
.(3)某温度时,在2L容器中,D、E、J三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为
N2+3H2 2NH3
2NH3
 2NH3
2NH3N2+3H2 2NH3
2NH3
.反应开始至2min,用J表示的平均反应速率为 2NH3
2NH30.05mol/L?min
0.05mol/L?min
.