摘要:用途:光导纤维.玛瑙饰物.石英坩埚.水晶镜片.石英钟.仪器轴承.玻璃和建筑材料等. 要点导悟 重难点一 碳和硅的比较 碳 硅 原子结构示意图 物理性质 晶体硅是灰黑色.有金属光泽.硬而脆的固体.硅和锗是重要的半导体材料 化学性质 在高温和点燃下有强还原性 2C + O2 2CO C + O2 CO2 3C + Fe2O3 2Fe + 3CO↑ ①加热条件下.能跟一些非金属单质起反应. Si + O2 SiO2 Si + 2H2 SiH4 ②常温下.不能强酸.强氧化性酸反应.只能与氟气.氢氟酸(HF)和烧碱等物质反应. Si + 2F2 == SiF4 Si + 4HF==SiF4 +H2↑ Si + 2NaOH + H2O == Na2SiO3 + 2H2↑ 工业制法 SiO2 + 2C Si + 2CO↑ (焦炭在电炉中还原二氧化硅得到粗硅)粗硅提纯后.可以得到可用作半导体材料的高纯硅. 用途 作还原剂.吸附剂 ①作半导体材料晶体管.集成电路.硅整流器和太阳能电池等, ②制合金:含硅4%的钢具有良好的导磁性--变压器铁芯, 含硅15%左右的钢具有良好的耐酸性--耐酸设备等. 重难点二 SiO2与CO2的比较 CO2 SiO2 与碱性氧化物反应 CaO+CO2CaCO3 CaO+SiO2 CaSiO3 与碱液反应 2NaOH+CO2=Na2CO3+H2O SiO2+2NaOH = Na2SiO3+H2O 与盐反应 Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓ NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 2Na2CO3+SiO2 Na2SiO3+CO2↑CaCO3+SiO2 CaSiO3+CO2↑ 与碳反应 C+CO22CO 2C+SiO2 Si+2CO↑ 与H2O作用 CO2+H2O H2CO3 不与水化合 与酸反应 不反应 只与HF反应 SiO2+4HF=SiF4↑+H2O 典型题解析 例.下列各单质和化合物之间有以下的转化关系.而且各单质和化合物组成的元素皆为短周期元素. 根据上述关系判断: (1)单质A可能是 .这是因为 . (2)单质B一定是金属还是非金属 .这是因为 . (3)各化合物的化学式为:甲 .乙 .丙 .丁 . 要点提示:本题是元素及化合物推断题.解题的突破口是短周期内元素的单质A与NaOH溶液反应生成氢气C的元素可能是Al和Si.而产生的化合物乙与过量盐酸溶液反应.生成的化合物丁能两次失去化合物丙生成化合物甲.则进一步推断出A单质不是金属Al.而只能是Si.又由于单质A和化合物甲都能跟NaOH溶液反应.都生成化合物乙(Na2SiO3).只不过A的另一种产物是氢气.而化合物甲的另一种产物为化合物丙.丙又可通过氢气与单质B反应生成.故单质B为O2.其它的各种化合物也就能推出来了. 答案: (1)硅Si,在短周期内.能与NaOH溶液反应放出氢气的只可能是铝和硅.但铝的氢氧化物可溶于过量盐酸中.不符合题意,故A只能是单质硅.(2)是非金属.硅只有和氧气反应.才能生成酸性氧化物(SiO2)与碱液甲SiO2.乙Na2SiO3.丙H2O.丁H4SiO4. 练习
网址:http://m.1010jiajiao.com/timu3_id_196949[举报]
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3和SiO2组成.某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si.

有关氢氧化物沉淀的pH见下表:
(1)写出不溶物B在生产中的一种用途:
(2)操作④中滤液E与过量CO2反应生成沉淀G的离子方程式为:
(3)操作⑤中调节pH到5~6时,可以用到的试剂(填序号)
a. NaOH溶液 b.氨水 c. Fe2O3 d. Mg(OH)2
(4)从滤液H制取金属Mg的流程如下:

Ⅰ.流程中由滤液H中得到MgCl2?6H2O的方法是
Ⅱ.在干燥的HCl气流中加热MgCl2?6H2O制取无水氯化镁的原因是
Ⅲ.冶炼镁的方法用化学方程式表示为
查看习题详情和答案>>

有关氢氧化物沉淀的pH见下表:
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
光导纤维
光导纤维
.(2)操作④中滤液E与过量CO2反应生成沉淀G的离子方程式为:
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
.(3)操作⑤中调节pH到5~6时,可以用到的试剂(填序号)
cd
cd
.a. NaOH溶液 b.氨水 c. Fe2O3 d. Mg(OH)2
(4)从滤液H制取金属Mg的流程如下:

Ⅰ.流程中由滤液H中得到MgCl2?6H2O的方法是
加热浓缩
加热浓缩
、冷却结晶
冷却结晶
、过滤、洗涤;Ⅱ.在干燥的HCl气流中加热MgCl2?6H2O制取无水氯化镁的原因是
Mg2++2H2O?Mg(OH)2+2H+,通入HCl,使C(H+)增大,抑制Mg2+的水解成Mg(OH)2,确保生成MgCl2
Mg2++2H2O?Mg(OH)2+2H+,通入HCl,使C(H+)增大,抑制Mg2+的水解成Mg(OH)2,确保生成MgCl2
.(应用离子方程式和简要文字说明)Ⅲ.冶炼镁的方法用化学方程式表示为
MgCl2
Mg+Cl2↑
| ||
| 熔融 |
MgCl2
Mg+Cl2↑
.
| ||
| 熔融 |
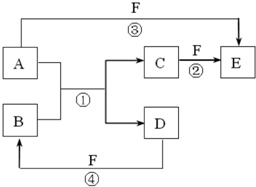 (2011?湖北模拟)A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应.
(2011?湖北模拟)A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应.请回答下列问题:
(1)若B是黄绿色气体,C、F是空气的主要成分,A、D相遇有白烟生成,则该白烟的化学式为
NH4Cl
NH4Cl
,反应③的化学方程式为4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(2)若A、D、F都是非金属单质,A、D所含元素同主族,A、F所含元素同周期,则B所属晶体类型是
原子晶体
原子晶体
,其一个重要的用途是光导纤维、石英钟表、石英玻璃等
光导纤维、石英钟表、石英玻璃等
.(3)若A是常见的金属单质,D、F是气态单质,反应①②在水溶液中进行,则反应②的离子方程式为
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
.工业上冶炼金属A的反应原理是(用化学方程式表示)Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
(4)若A、D是常见单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,反应③④中都有红棕色气体生成.则反应①的化学方程式为
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
下列表述正确的是
①普通玻璃与钢化玻璃成分不同,所以性能不同,用途不同
②光导纤维导电能力很强,是非常好的通讯材料
③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④氧化钴加入到普通玻璃中可制成红色玻璃
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
- A.①②③
- B.②④
- C.③④⑤
- D.③⑤
|
下列表述正确的是 ①普通玻璃与钢化玻璃成分不同,所以性能不同,用途不同 ②光导纤维导电能力很强,是非常好的通讯材料 ③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料 ④氧化钴加入到普通玻璃中可制成红色玻璃 ⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能 | |
A. |
①②③ |
B. |
②④ |
C. |
③④⑤ |
D. |
③⑤ |
|
下列表述正确的是 ①普通玻璃与钢化玻璃成分不同,所以性能不同,用途不同 ②光导纤维导电能力很强,是非常好的通讯材料 ③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料 ④氧化钴加入到普通玻璃中可制成红色玻璃 ⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能 | |
| [ ] | |
A. |
①②③ |
B. |
②④ |
C. |
③④⑤ |
D. |
③⑤ |