摘要:21.如图是一位同学设计的实验室制取氯气的实验装置图. (1)写出该反应的化学方程式 , (2)上述反应中.还原剂是 .若有1mol氧化剂参加反应.生成的氯气在标准状况下的体积为 L, (3)实验开始前.某学生对装置进行了气密性检查.方法是:连接好装置后.用弹簧夹夹住 处(填"A"或"B")橡皮管,打开活塞向分液漏斗中加水.当加到一定量时.停止加水.静置观察.当观察到分液漏斗中 时.表明该装置不漏气, (4)指出这套装置中存在的错误 , (5)烧杯里装有氢氧化钠溶液.其作用是 .发生反应的化学方程式是 .
网址:http://m.1010jiajiao.com/timu3_id_196585[举报]
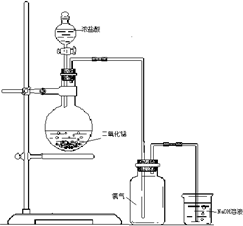 如图是一位同学设计的实验室制取氯气的实验装置图.
如图是一位同学设计的实验室制取氯气的实验装置图.(1)指出这套装置中存在的错误
(2)烧杯里装有氢氧化钠溶液,其作用是
(3)把Cl2通入NaBr溶液中,并向其中加入少量四氯化碳,振荡后静置,液体分为两层,上层为
实验室制乙酸乙酯得主要装置如图中A所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯.

请回答下列问题:
(1)步骤①中,配制这一比例的混合液的正确操作是
(2)若实验中用含18O的乙醇与乙酸作用,该反应得化学方程式是:
(3)步骤③中,要用小火加热,其原因是
(4)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:
(5)A装置中使用球形管除起到冷凝作用外,另一重要作用是
(6)为充分利用反应物,甲、乙两位同学分别设计了图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为合理的是
查看习题详情和答案>>

请回答下列问题:
(1)步骤①中,配制这一比例的混合液的正确操作是
在试管中加入3mL乙醇,然后边摇动边加入2mL浓硫酸和2mL乙酸;
在试管中加入3mL乙醇,然后边摇动边加入2mL浓硫酸和2mL乙酸;
.(2)若实验中用含18O的乙醇与乙酸作用,该反应得化学方程式是:
CH3COOH+CH3CH218OH
CH3CO18OC2H5+H2O
| 浓硫酸 |
| 加热 |
CH3COOH+CH3CH218OH
CH3CO18OC2H5+H2O
.| 浓硫酸 |
| 加热 |
(3)步骤③中,要用小火加热,其原因是
防止温度过高,乙酸乙醇挥发溢出;
防止温度过高,乙酸乙醇挥发溢出;
.(4)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:
2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑
2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑
.(5)A装置中使用球形管除起到冷凝作用外,另一重要作用是
防止倒吸;
防止倒吸;
,步骤⑤中分离乙酸乙酯必须使用的一种仪器是分液漏斗;
分液漏斗;
.(6)为充分利用反应物,甲、乙两位同学分别设计了图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为合理的是
乙
乙
.实验室制乙酸乙酯得主要装置如图中A所示,主要步骤
①在a试管中按2∶3∶2的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;
③小火加热a试管中的混合液;
④等b试管中收集到约2 mL产物时停止加热。撤下b试管并用力振荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯。
①在a试管中按2∶3∶2的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;
③小火加热a试管中的混合液;
④等b试管中收集到约2 mL产物时停止加热。撤下b试管并用力振荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯。

请回答下列问题:
(1)步骤①中,配制这一比例的混合液的正确操作是______________________。
(2)若实验中用含18O的乙醇与乙酸作用,该反应得化学方程式是:______________________。
(3)步骤③中,要用小火加热,其原因是______________________。
(4)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:__________________。
(5)A装置中使用球形管除起到冷凝作用外,另一重要作用是______________________,步骤⑤中分离乙酸乙酯必须使用的一种仪器是______________________。
(6)为充分利用反应物,甲、乙两位同学分别设计了图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物)。你认为合理的是______________。
查看习题详情和答案>>
(1)步骤①中,配制这一比例的混合液的正确操作是______________________。
(2)若实验中用含18O的乙醇与乙酸作用,该反应得化学方程式是:______________________。
(3)步骤③中,要用小火加热,其原因是______________________。
(4)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:__________________。
(5)A装置中使用球形管除起到冷凝作用外,另一重要作用是______________________,步骤⑤中分离乙酸乙酯必须使用的一种仪器是______________________。
(6)为充分利用反应物,甲、乙两位同学分别设计了图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物)。你认为合理的是______________。
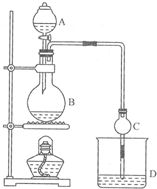 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是
制乙酸、催化剂、脱水剂
制乙酸、催化剂、脱水剂
;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH
CH3CO18OC2H5+H2O
| 浓硫酸 |
| △ |
CH3COOH+CH3CH218OH
CH3CO18OC2H5+H2O
| 浓硫酸 |
| △ |
(2)球形干燥管C的作用是
防止倒吸、冷凝
防止倒吸、冷凝
.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
;反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅
溶液分层,上层无色油体液体,下层溶液颜色变浅
.(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出
乙醇
乙醇
;再加入(此空从下列选项中选择)C
C
,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯.A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/ | 34 | 78.5 | 118 | 77 |
(1)浓硫酸的作用是
(2)球形干燥管C的作用是
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出