摘要:6.元素周期表是学习化学的重要工具.右图是元素周期表中的一格.从中获取的信息不正确的是 A.该元素的原子序数为20 B.该元素中子数为40 C.该元素的原子核外有20个电子 D.该元素的相对原子质量为40.08
网址:http://m.1010jiajiao.com/timu3_id_19602[举报]
(2012?红桥区一模)元素周期表是学习化学的重工具,下表是元素周期表的一部分.
根据所学知识回答:
(1)13号元素的符号是
(2)9号元素的原子结构示意图 ,其中x为
,其中x为
(3)由1号元素和8号元素组成的阴离子符号为
查看习题详情和答案>>
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | 1 H 氢 1.008 |
ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | 6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
||||
| 3 | 11 Na 钠 22.99 |
12 Mg 镁 24.31 |
铝 |
(1)13号元素的符号是
Al
Al
;11号元素属于金属
金属
(填“金属”或“非金属”)元素.(2)9号元素的原子结构示意图
 ,其中x为
,其中x为7
7
.(3)由1号元素和8号元素组成的阴离子符号为
OH-
OH-
;由1、6、7和8号元素组成的盐的化学式为NH4HCO3(合理即可)
NH4HCO3(合理即可)
.元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
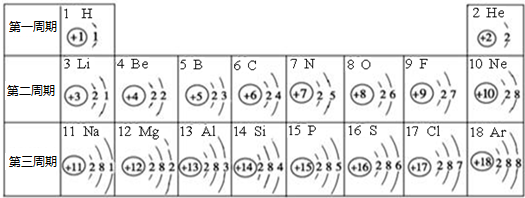
(1)第16号元素属于
(2)元素的化学性质与原子结构中的
(3)在同一族中各元素的原子结构呈现的规律有
(4)研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的吸引力逐渐增大,故原子半径逐渐减小.我分析第三周期从11~17号元素原子半径变化规律是
查看习题详情和答案>>

(1)第16号元素属于
非
非
金属元素(填“金属”或“非金属”),它在化学反应中容易得
得
失(填“得”或“失”)电子,所形成的微粒的符号:S2-
S2-
Mg2+(2)元素的化学性质与原子结构中的
原子核外
原子核外
最外层电子数关系密切.(3)在同一族中各元素的原子结构呈现的规律有
最外层电子数相同
最外层电子数相同
(任写一点)(4)研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的吸引力逐渐增大,故原子半径逐渐减小.我分析第三周期从11~17号元素原子半径变化规律是
原子半径逐渐减小
原子半径逐渐减小
.元素周期表是学习化学的重要工具,下表是元素周期表的一部分:
请回答下列问题:
(1)从表中可以知道,下列关于氟原子的说法正确的是
A.中子数为9 B.氟原子的核外有9个电子
C.氟原子的相对原子质喇为19.00g D.氟是金属元素
(2)下列粒子中:①与镁原子化学性质相似的是

(3)由l号和8号元素组成的化合物(分子中原子个数比为2:1)与6号元素的单质,在高温下发生置换反应,生成一种最轻的气体和一种由双原子分子构成的化合物,该反应的化学方程式是
查看习题详情和答案>>
| 1H (1.008 |
2He (4.003 | ||||||
| 3Li (6.941 |
4Be (9.01 |
5B (10.81 |
6C (12.01 |
7N (14.01 |
8O (16.00 |
9F (19.00 |
10Ne (20.18 |
| 11Na (22.99 |
12Mg (24.31 |
13Al (26.98 |
14Si (28.09 |
15P (30.97 |
16S (32.06 |
17Cl (35.45 |
18Ar (39.95 |
(1)从表中可以知道,下列关于氟原子的说法正确的是
B
B
A.中子数为9 B.氟原子的核外有9个电子
C.氟原子的相对原子质喇为19.00g D.氟是金属元素
(2)下列粒子中:①与镁原子化学性质相似的是
C
C
(填写序号);②与镁元素在同一周期的是AD
AD
(填写序号);
(3)由l号和8号元素组成的化合物(分子中原子个数比为2:1)与6号元素的单质,在高温下发生置换反应,生成一种最轻的气体和一种由双原子分子构成的化合物,该反应的化学方程式是
H2O+C
CO+H2
| ||
H2O+C
CO+H2
.
| ||

 其中x为
其中x为
 (2012?泉州)元素周期表是学习化学的重要工具.如图所示的是元素周期表中的一格,从中获得的信息正确的是( )
(2012?泉州)元素周期表是学习化学的重要工具.如图所示的是元素周期表中的一格,从中获得的信息正确的是( )