网址:http://m.1010jiajiao.com/timu3_id_195871[举报]
硼元素B在化学中有很重要的地位.硼的化合物在农业、医院、玻璃等方面用途很广.请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子分布式______,从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为______.
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料,同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是______.
(3)在BF3分子中中心原子的杂化轨道类型是______,SiF4微粒的空间构型是______.
(4)科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列.如图所示是该晶体微观窨中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上.根据图示确定硼化镁的化学式为______.
化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。(1) 铝热反应在工业生产中的重要用途之一是 ;用化学方程式表示出其中的原理 (举一例)。铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸碱破坏,若将氧化铝与氢氧化钠溶液作用,反应的化学方程式为 。
(2)氯气用于漂白、消毒时,能起漂白、消毒作用的物质是 (写化学式)。缺铁性贫血患者应补充Fe元素,通常以硫酸亚铁的形式给药,而硫酸铁则没有这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是 。
(3)镁带着火时,不能用液态CO2灭火剂来灭火的原因是
。(用化学方程式表示)。
(4)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2 + 3 C = 2AlN + 3CO
①在化学方程式上标出该反应中电子转移的方向和数目。
②在该反应中,氧化剂是 ,氧化产物是 。
查看习题详情和答案>>硼元素B在化学中有很重要的地位.硼的化合物在农业、医院、玻璃等方面用途很广.请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子分布式______,从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为______.
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料,同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是______.
(3)在BF3分子中中心原子的杂化轨道类型是______,SiF4微粒的空间构型是______.
(4)科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列.如图所示是该晶体微观窨中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上.根据图示确定硼化镁的化学式为______.
 查看习题详情和答案>>
查看习题详情和答案>>
镁和海水提镁
1.海水中镁的含量
总储量:1.28 g·L-1,世界上有60%镁来自于海水.
2.海水提镁的工业流程
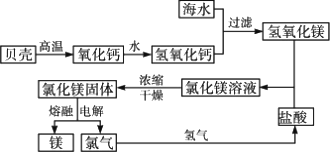
讨论:贝壳在生产流程中起提供Mg2+沉淀剂的作用.其主要成分发生了分解反应:
CaCO3![]() CaO+CO2↑
CaO+CO2↑
3.镁的性质和用途
(1)镁的主要物理性质:密度________、强度________、机械性能好的银白色金属.
(2)镁的化学性质
①与非金属单质反应
2Mg+O2![]() ________
________
Mg+Cl2![]() ________
________
3Mg+N2![]() ________
________
②与CO2反应
2Mg+CO2![]() ________
________
③与酸反应
2Mg+2HCl![]() ________
________
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别 占4%、l8%
I.(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g) 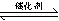 2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的最佳途径是使用高效催化剂 |
| C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 |
| D.提高尾气净化效率的常用方法是升高温度 |
 N2(g)+CO2(g)
N2(g)+CO2(g)  H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:| 浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
①T1℃时,该反应的平衡常数K= (保留两位小数)。
⑦前10min内用v(NO)表示的化学反应速率为 ,30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:l,则该反应的a 0(填“>”、“=”或“<”)。
Ⅱ.CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。
(1)工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示
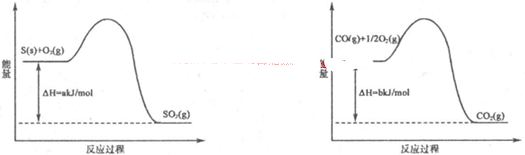
则用SO2除去CO的热化学方程式为 。
(2)高温时,也可以用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此反应的化学方程式是 。
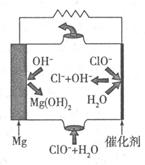
②由Mg可制成“镁一次氯酸盐”电池,其装置示意图如图,则镁电极发生的电极反应式为 ,该电池总反应的离子方程式为 。
 查看习题详情和答案>>
查看习题详情和答案>>