摘要:工业上常用加入K2Cr2O7氧化剂的办法氧化Na2SO3.现已知1mol K2Cr2O7能把3 mol Na2SO3恰好氧化为Na2SO4.K2Cr2O7被还原为Crn+.则n的值为 A.+2 B.+3 C.+4 D.+5
网址:http://m.1010jiajiao.com/timu3_id_195482[举报]
 海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.(1)目前国际上实用的“海水淡化”主要技术是蒸馏法.蒸馏法是将海水变成蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是
物理变化
物理变化
(填物理变化、化学变化).(2)工业上利用电解饱和食盐水可制得重要化工产品.电解饱和食盐水的离子方程式为
2Cl-+2H2O
2OH-+Cl2↑+H2↑
| ||
2Cl-+2H2O
2OH-+Cl2↑+H2↑
;
| ||
(3)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂,工业上常用Cl2通入石灰乳中制备漂白粉,漂白粉的有效成分是(填化学方程式)
Ca(ClO)2
Ca(ClO)2
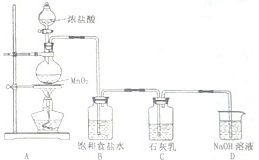
.(4)某学生设计如图所示的实验装置,利用氯气与石灰乳反应制取少量漂白粉(该反应是一个放热反应),据此回答下列问题:
①在A装置中用固体二氧化锰与浓硫酸在加热条件下制取氯气,反应化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
,若在标准状况下收集到22.4升的氯气,则被氧化的HCl的物质的量是
| ||
2mol
2mol
.②D装置的作用是
吸收尾气,防止污染大气
吸收尾气,防止污染大气
.③此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,其中一个原因是在装置C中还存在一个副反应:温度较高时氯气与石灰乳反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
将装置C放在冰水中降温
将装置C放在冰水中降温
.④在家庭中漂白粉是一种常用的漂白剂,在空气中漂白粉漂白原理是(用化学反应方程式表示):
Ca(ClO)2+CO2+H2O=2HClO+CaCO3
Ca(ClO)2+CO2+H2O=2HClO+CaCO3
.为增强漂白粉的漂白能力,可加入少量的物质是B
B
.A.食盐B.食醋D.烧碱D.纯碱.
电子工业上常用氯化铁溶液腐蚀铜来制印刷电路板.现将有一定量铜的印刷电路板放入氯化铁溶液中,完全反应后,溶液中Fe2+和Fe3+物质的量浓度相等.
(1)写出铜与氯化铁反应的离子方程式:
(2)溶液中Cu2+和Fe3+的物质的量浓度之比为
(3)若再向上述所得溶液中加入一定量铜粉,经充分反应后,溶液中金属阳离子只有Cu2+和Fe2+,此时Cu2+和Fe2+物质的量浓度之比为
查看习题详情和答案>>
(1)写出铜与氯化铁反应的离子方程式:
Cu+2Fe3+═Cu2++2Fe2+
Cu+2Fe3+═Cu2++2Fe2+
;(2)溶液中Cu2+和Fe3+的物质的量浓度之比为
1:2
1:2
;(3)若再向上述所得溶液中加入一定量铜粉,经充分反应后,溶液中金属阳离子只有Cu2+和Fe2+,此时Cu2+和Fe2+物质的量浓度之比为
1:2
1:2
.(2011?焦作一模)工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一](1)将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,应选用
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O═2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体.为此设计了下列探究实验装置(图中夹持仪器省略).

(3)装置B中试剂的作用是
(4)认为气体Y中还含有Q的理由是
(5)为确认Q的存在,需在装置中添加M于
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是
查看习题详情和答案>>
[探究一](1)将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
铁钉表面被钝化
铁钉表面被钝化
.(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,应选用
d
d
(选填序号).a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O═2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为
66.7%.
66.7%.
.[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体.为此设计了下列探究实验装置(图中夹持仪器省略).

(3)装置B中试剂的作用是
检验SO2是否除尽
检验SO2是否除尽
.(4)认为气体Y中还含有Q的理由是
C+2H2SO4(浓硫酸)
CO2 ↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓硫酸)
CO2 ↑+2SO2↑+2H2O
(用化学方程式表示).
| ||
(5)为确认Q的存在,需在装置中添加M于
C
C
(选填序号).a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是
D中固体由黑变红和E中固体由白变蓝
D中固体由黑变红和E中固体由白变蓝
.水处理技术在生产、生活中应用广泛.
(1)工业上常用绿矾做混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理的水pH调到9左右,再加入绿矾.请解释这一做法的原因: (用必要的离子方程式和文字描述).
(2)根据水中Ca2+,Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用.
①硬水软化的方法通常有 、 和离子交换法.离子交换树脂使用了一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力.把CaR2(或MgR2)型树脂置于 中浸泡一段时间,便可再生.
②当洗涤用水硬度较大时,洗衣粉与肥皂相比, 洗涤效果较好,原因是 .
(3)最近我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性碳,活性炭的作用是 .
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理.首先在
消化细菌作用下将N
氧化为N
: N
+ O2═ N
+ H++ H2O.然后,加入甲醇与N
生成N2: N
+ CH3OH═ N2+ CO2+ H2O+ OH-(试配平以上两个离子方程式).
查看习题详情和答案>>
(1)工业上常用绿矾做混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理的水pH调到9左右,再加入绿矾.请解释这一做法的原因:
(2)根据水中Ca2+,Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用.
①硬水软化的方法通常有
②当洗涤用水硬度较大时,洗衣粉与肥皂相比,
(3)最近我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性碳,活性炭的作用是
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理.首先在
消化细菌作用下将N
| H | + 4 |
| O | - 3 |
| H | + 4 |
| O | - 3 |
| O | - 3 |
| O | - 3 |