题目内容
 海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.(1)目前国际上实用的“海水淡化”主要技术是蒸馏法.蒸馏法是将海水变成蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是
物理变化
物理变化
(填物理变化、化学变化).(2)工业上利用电解饱和食盐水可制得重要化工产品.电解饱和食盐水的离子方程式为
2Cl-+2H2O
2OH-+Cl2↑+H2↑
| ||
2Cl-+2H2O
2OH-+Cl2↑+H2↑
;
| ||
(3)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂,工业上常用Cl2通入石灰乳中制备漂白粉,漂白粉的有效成分是(填化学方程式)
Ca(ClO)2
Ca(ClO)2
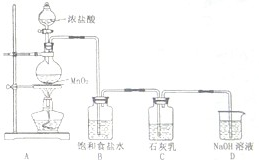
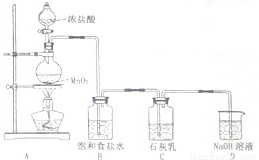
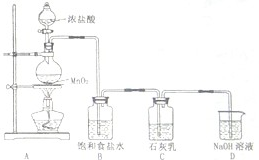
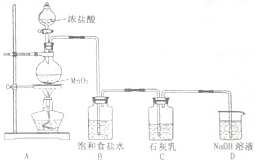
.(4)某学生设计如图所示的实验装置,利用氯气与石灰乳反应制取少量漂白粉(该反应是一个放热反应),据此回答下列问题:
①在A装置中用固体二氧化锰与浓硫酸在加热条件下制取氯气,反应化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
,若在标准状况下收集到22.4升的氯气,则被氧化的HCl的物质的量是
| ||
2mol
2mol
.②D装置的作用是
吸收尾气,防止污染大气
吸收尾气,防止污染大气
.③此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,其中一个原因是在装置C中还存在一个副反应:温度较高时氯气与石灰乳反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
将装置C放在冰水中降温
将装置C放在冰水中降温
.④在家庭中漂白粉是一种常用的漂白剂,在空气中漂白粉漂白原理是(用化学反应方程式表示):
Ca(ClO)2+CO2+H2O=2HClO+CaCO3
Ca(ClO)2+CO2+H2O=2HClO+CaCO3
.为增强漂白粉的漂白能力,可加入少量的物质是B
B
.A.食盐B.食醋D.烧碱D.纯碱.
分析:(1)蒸馏是利用物质的沸点不同进行分离;
(2)根据工业电解饱和食盐水的产物书写;
(3)漂白粉的有效成分为Ca(ClO)2;
(4)①二氧化锰与浓硫酸在加热条件下生成MnCl2、Cl2、H2O,根据化合价的变化判断;
②为防止氯气污染空气,应进行尾气吸收;
③根据题给信息,为制得更多的次氯酸钙,应在低温下进行;
④次氯酸的酸性比碳酸弱,在空气中可生成具有漂白性的次氯酸,生成的次氯酸浓度越大,漂白效果更好.
(2)根据工业电解饱和食盐水的产物书写;
(3)漂白粉的有效成分为Ca(ClO)2;
(4)①二氧化锰与浓硫酸在加热条件下生成MnCl2、Cl2、H2O,根据化合价的变化判断;
②为防止氯气污染空气,应进行尾气吸收;
③根据题给信息,为制得更多的次氯酸钙,应在低温下进行;
④次氯酸的酸性比碳酸弱,在空气中可生成具有漂白性的次氯酸,生成的次氯酸浓度越大,漂白效果更好.
解答:解:(1)蒸馏是利用物质的沸点不同进行分离,沸点属于物理性质,故答案为:物理变化;
(2)工业电解饱和食盐水生成氢气和氯气,反应的离子方程式为2Cl-+2H2O
2OH-+Cl2↑+H2↑,
故答案为:2Cl-+2H2O
2OH-+Cl2↑+H2↑;
(3)漂白粉的有效成分为Ca(ClO)2,可生成具有漂白性的HClO,故答案为:Ca(ClO)2;
(4)①二氧化锰与浓硫酸在加热条件下生成MnCl2、Cl2、H2O,反应的方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,n(Cl2)=1mol,被氧化的HCl的物质的量是2mol,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;2mol;
②氯气可与NaOH溶液反应,为防止氯气污染空气,应进行尾气吸收,故答案为:吸收尾气,防止污染大气;
③根据题给信息,为制得更多的次氯酸钙,应在低温下进行,可放在冰水中降温,故答案为:将装置C放在冰水中降温;
④次氯酸的酸性比碳酸弱,在空气中可生成具有漂白性的次氯酸,反应的方程式为Ca(ClO)2+CO2+H2O=2HClO+CaCO3,为生成更多的HClO,可加入醋酸,
故答案为:Ca(ClO)2+CO2+H2O=2HClO+CaCO3; B.
(2)工业电解饱和食盐水生成氢气和氯气,反应的离子方程式为2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
(3)漂白粉的有效成分为Ca(ClO)2,可生成具有漂白性的HClO,故答案为:Ca(ClO)2;
(4)①二氧化锰与浓硫酸在加热条件下生成MnCl2、Cl2、H2O,反应的方程式为MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
②氯气可与NaOH溶液反应,为防止氯气污染空气,应进行尾气吸收,故答案为:吸收尾气,防止污染大气;
③根据题给信息,为制得更多的次氯酸钙,应在低温下进行,可放在冰水中降温,故答案为:将装置C放在冰水中降温;
④次氯酸的酸性比碳酸弱,在空气中可生成具有漂白性的次氯酸,反应的方程式为Ca(ClO)2+CO2+H2O=2HClO+CaCO3,为生成更多的HClO,可加入醋酸,
故答案为:Ca(ClO)2+CO2+H2O=2HClO+CaCO3; B.
点评:本题考查较为综合,设计元素化合物知识以及实验设计等问题,题目难度中等,建议在学习中牢固把握相关物质的性质.

练习册系列答案
相关题目
 海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.