摘要:在H2S+H2SO4(浓)===S +SO2 +2H2O反应中还原产物是 A.S B.SO2 C.H2O D.不好确定
网址:http://m.1010jiajiao.com/timu3_id_195480[举报]
(2011?如皋市模拟)绿矾(FeSO4?7H2O)是治疗缺铁性贫血的特效药.下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:
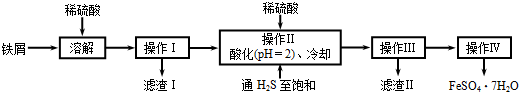
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是
(2)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②
(3)操作IV的顺序依次为:
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时发生反应的离子方程式为:5Fe2++MnO-4+8H+═5Fe3++Mn2++4H2O).
①计算上述样品中FeSO4?7H2O的质量分数为
②若用上述方法测定的样品中FeSO4?7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有
查看习题详情和答案>>

已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是
取少量晶体溶于水,滴加KSCN溶液,若不出现血红色,表明不含有Fe3+
取少量晶体溶于水,滴加KSCN溶液,若不出现血红色,表明不含有Fe3+
.(2)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是
使Sn2+完全变成SnS沉淀,而Fe2+不沉淀,
使Sn2+完全变成SnS沉淀,而Fe2+不沉淀,
;通入硫化氢至饱和的目的是:①除去操作I所得溶液中含有的Sn2+等杂质离子;
②
防止Fe2+的氧化
防止Fe2+的氧化
.(3)操作IV的顺序依次为:
蒸发
蒸发
、结晶过滤洗涤
过滤洗涤
.(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②
降低洗涤过程中FeSO4?7H2O的损耗
降低洗涤过程中FeSO4?7H2O的损耗
.(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时发生反应的离子方程式为:5Fe2++MnO-4+8H+═5Fe3++Mn2++4H2O).
①计算上述样品中FeSO4?7H2O的质量分数为
97.54%
97.54%
.②若用上述方法测定的样品中FeSO4?7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有
样品中存在少量的杂质(如H2O、H2SO4等)
样品中存在少量的杂质(如H2O、H2SO4等)
;样品部分被氧化
样品部分被氧化
.(2013?闸北区二模)高锰酸钾可用于除去地下水的硫化氢异味的原理是生成的硫和二氧化锰等沉淀物可过滤除去.水体呈弱酸性时,高锰酸钾的还原产物是MnO和MnO2,且MnO和MnO2的物质的量比为3:1.
(1)写出并配平上述化学方程式,标出电子转移方向与数目.KMnO4+H2S+H2SO4→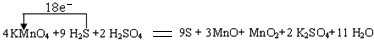
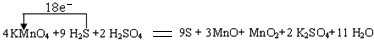 在处理饮用水时,活性炭应在高锰酸钾反应结束后投加,否则会发生反应:KMnO4+C+H2O→MnO2+X+K2CO3(未配平)
在处理饮用水时,活性炭应在高锰酸钾反应结束后投加,否则会发生反应:KMnO4+C+H2O→MnO2+X+K2CO3(未配平)
(2)X的化学式为
(3)1mol氧化剂被
查看习题详情和答案>>
(1)写出并配平上述化学方程式,标出电子转移方向与数目.KMnO4+H2S+H2SO4→
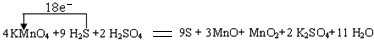
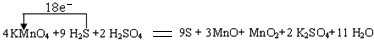
(2)X的化学式为
KHCO3
KHCO3
.(3)1mol氧化剂被
还原
还原
(填“氧化”或“还原”)时,生成0.75
0.75
mol氧化产物.
(1)K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O (用“单线桥”表示电子转移的方向和数目)氧化剂是 ,氧化产物与还原产物的物质的量之比为 .
(2) mol H2O中共含有9.03×1022个原子,其质量为 .
(3)配平下列氧化还原反应方程式:
KMnO4+ H2S+ H2SO4(稀)- MnSO4+ S↓+ K2SO4+ H2O
(4)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为 L.
查看习题详情和答案>>
(2)
(3)配平下列氧化还原反应方程式:
(4)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为