摘要:05mol/L( ) (4).20mL0.1mol/L的AlCl3溶液中Cl-的浓度为0.3mol/L( )
网址:http://m.1010jiajiao.com/timu3_id_195403[举报]
为了减少温室气体排放,目前工业上采用CO2与H2在CuO-ZnO/ZrO催化下反应制备重要化工原料CH3OH的工艺:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H<0.为了探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
根据题目回答下列问题:
(1)0~3s内用H2表示的平均反应速率是
(2)平衡时CO2的转化率是
(3)能说明反应已达平衡状态的是
A.υ(H2)=3υ(CO2) B.容器内压强保持不变 C.υ逆(CO2)=υ正(CH3OH) D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是
A.及时分离出产物 B.适当升高温度 C.增大CO2浓度 D.选择适当的催化剂.
查看习题详情和答案>>
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
(1)0~3s内用H2表示的平均反应速率是
0.05mol?L-1?S-1
0.05mol?L-1?S-1
,(2)平衡时CO2的转化率是
25%
25%
.(3)能说明反应已达平衡状态的是
BC
BC
.A.υ(H2)=3υ(CO2) B.容器内压强保持不变 C.υ逆(CO2)=υ正(CH3OH) D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是
C
C
.(填序号)A.及时分离出产物 B.适当升高温度 C.增大CO2浓度 D.选择适当的催化剂.
(2012?东城区二模)SO2随意排放会造成严重的大气污染.下列是某小组同学设计处理烟气(主要含SO2、N2、O2、粉尘)中SO2的方法.
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:
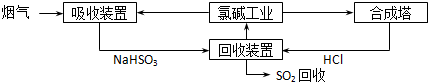
①“吸收装置”中发生反应的离子方程式是
②合成塔中每合成1mol 气体放出热量92.3kJ(25℃、101kPa),反应的热化学方程式是
③上述流程中循环利用的物质是
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2.
①该反应的离子方程式是
②利用胶体的
③根据反应b,说明步骤ⅱ中液体颜色变化的原因是
④经讨论后得出结论:FeCl3溶液和SO2反应过程中,反应a、b在体系中共存.请从化学反应速率和反应限度的角度分析,SO2通入FeCl3溶液中产生上述现象的原因是
查看习题详情和答案>>
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:

①“吸收装置”中发生反应的离子方程式是
SO2+OH-=HSO3-
SO2+OH-=HSO3-
;②合成塔中每合成1mol 气体放出热量92.3kJ(25℃、101kPa),反应的热化学方程式是
H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ?mol-1
H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ?mol-1
;③上述流程中循环利用的物质是
NaCl溶液
NaCl溶液
.(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2.
①该反应的离子方程式是
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
(反应a).为验证该反应,同学们将SO2通入0.05mol?L-1 FeCl3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色.关于红褐色液体,以下是同学们的分析推测与实验.| 分析推测 | 实验步骤 | ||
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 Fe(SO2)
|
ⅰ.制备Fe(OH)3胶体并检验 ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
丁达尔效应
丁达尔效应
(填性质)可以检验步骤ⅰ中是否得到了Fe(OH)3胶体;③根据反应b,说明步骤ⅱ中液体颜色变化的原因是
加入铁粉时发生反应2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应b逆向移动
加入铁粉时发生反应2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应b逆向移动
(用离子方程式及必要的文字说明);④经讨论后得出结论:FeCl3溶液和SO2反应过程中,反应a、b在体系中共存.请从化学反应速率和反应限度的角度分析,SO2通入FeCl3溶液中产生上述现象的原因是
由于化学反应速率:b>a,化学反应限度:a>b,所以产生上述现象
由于化学反应速率:b>a,化学反应限度:a>b,所以产生上述现象
.