摘要:2.用m g 10%的NaOH溶液.蒸发掉4 g水后.余下溶液10 mL.溶质的质量分数为15%.浓缩后碱液的物质的量浓度是 A. 1.8 mol / L B. 2.3 mol / L C. 3 mol / L D. 4.4 mol / L 3.将硫酸钾.硫酸铝.硫酸钾铝三种盐混合溶于硫酸酸化的水中.测得c()=0.105 mol / L.c(Al3+)=0.055 mol / L.溶液的pH=2.0(假设溶液中H2SO4完全电离为H+和).则c (K+)为 A. 0.045 mol / L B. 0.035 mol / L C. 0.055 mol / L D. 0.040 mol / L
网址:http://m.1010jiajiao.com/timu3_id_195326[举报]
对于反应2N(g)+3M(g)?XQ(g)+3R(g),在容积为4L的密闭容器中,将2mol气体N和3mol气体M混合,当反应经2min后达平衡时生成2.4mol气体R,并测得Q的浓度为0.4mol/L,则X的值为
查看习题详情和答案>>
2
2
,M的转化率为80%
80%
,用M物质表示的反应速率vM=0.3mol/(L.min)
0.3mol/(L.min)
. A、B、C、D、E是Na的单质及其化合物,它们有如图所示的相互转化关系.
A、B、C、D、E是Na的单质及其化合物,它们有如图所示的相互转化关系.(1)写出以下物质的化学式:C
Na2O2
Na2O2
;FNaHCO3
NaHCO3
(2)完成以下离子方程式:
C→D:
2Na2O2+2H2O=4Na++4OH-+O2↑
2Na2O2+2H2O=4Na++4OH-+O2↑
D→E:
2OH-+CO2=CO32-+H2O
2OH-+CO2=CO32-+H2O
(3)等质量的A和B分别投入到等质量且足量的水中,反应后所得溶液溶质质量分数分别为
ω1、ω2,则ω1
>
>
ω2 (填“>”或“<”或“═”).(4)E中混有少量的F,用化学方程式表示除去F的两种方法:
NaHCO3+NaOH=Na2CO3+H2O
NaHCO3+NaOH=Na2CO3+H2O
、2NaHCO3
Na2CO3+CO2↑+H2O
| ||
2NaHCO3
Na2CO3+CO2↑+H2O
| ||
(5)用m g的D来制取纯净的E,写出最简单的实验方法
将mgNaOH固体加一定量的水溶解,制成溶液.再将溶液分为等体积的两份,一份通入足量CO2,充分反应后与另一份溶液混合.最后再将溶液蒸干
将mgNaOH固体加一定量的水溶解,制成溶液.再将溶液分为等体积的两份,一份通入足量CO2,充分反应后与另一份溶液混合.最后再将溶液蒸干
.(2013?绵阳模拟)在某锂离子电池中,有一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如图1:
用相对分子质量为56的单烯烃A合成M的 方法可设计如图2:
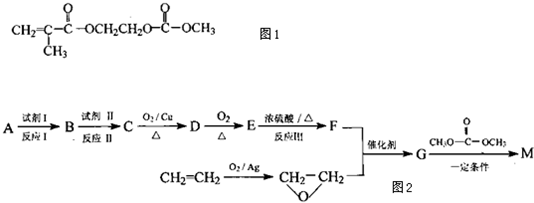
请回答下列问题:
(1)A的结构简式是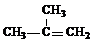
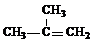 试剂Ⅱ是
试剂Ⅱ是
(2)G在一定条件下反应生成的高聚物是制备隐形眼镜的材料,请写出生成该高聚物的 化学反应方程式
(3)M与足量氯氧化钠溶液反应的化学方程式是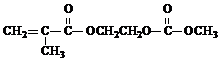 +3NaOH→
+3NaOH→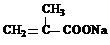 +HOCH2CH2OH+Na2CO3+CH3OH
+HOCH2CH2OH+Na2CO3+CH3OH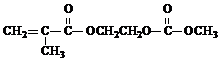 +3NaOH→
+3NaOH→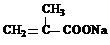 +HOCH2CH2OH+Na2CO3+CH3OH
+HOCH2CH2OH+Na2CO3+CH3OH
(4)在用E制备F的过程中,2分子的E反应会生成一种副产物,其核磁共振氢谱只有 一种吸收峰,该副产物的结构简式为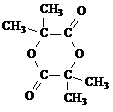
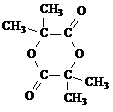 .
.
查看习题详情和答案>>
用相对分子质量为56的单烯烃A合成M的 方法可设计如图2:

请回答下列问题:
(1)A的结构简式是
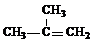
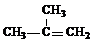
NaOH水溶液
NaOH水溶液
,反应Ⅲ的化学反应类型是消去反应
消去反应
.(2)G在一定条件下反应生成的高聚物是制备隐形眼镜的材料,请写出生成该高聚物的 化学反应方程式
n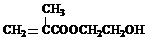
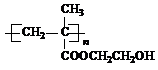
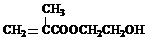
| 一定条件 |
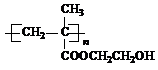
n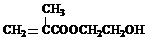
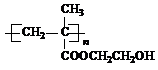
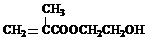
| 一定条件 |
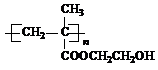
(3)M与足量氯氧化钠溶液反应的化学方程式是
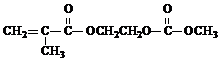 +3NaOH→
+3NaOH→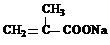 +HOCH2CH2OH+Na2CO3+CH3OH
+HOCH2CH2OH+Na2CO3+CH3OH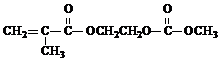 +3NaOH→
+3NaOH→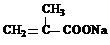 +HOCH2CH2OH+Na2CO3+CH3OH
+HOCH2CH2OH+Na2CO3+CH3OH(4)在用E制备F的过程中,2分子的E反应会生成一种副产物,其核磁共振氢谱只有 一种吸收峰,该副产物的结构简式为
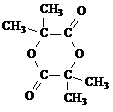
 (2012?朝阳区二模)氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3?6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):
(2012?朝阳区二模)氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3?6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):操作步骤如下:
Ⅰ.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1、打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeCl3?6H2O晶体.请回答:
(1)A中发生的置换反应的化学方程式是
Fe+2HCl=FeCl2+H2
Fe+2HCl=FeCl2+H2
.(2)操作Ⅱ中“…”的内容是
当A中固体完全消失
当A中固体完全消失
,烧杯中的现象是无色溶液逐渐变黄
无色溶液逐渐变黄
,相应的离子方程式和化学方程式是2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
、2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(3)操作Ⅲ不采用直接加热制FeCl3?6H2O晶体的原因是
Fe3++3H2O?Fe(OH)3+3H+,加热会促进FeCl3水解,产生Fe(OH)3
Fe3++3H2O?Fe(OH)3+3H+,加热会促进FeCl3水解,产生Fe(OH)3
(用简要文字并结合离子方程式解释).(4)测得B中所得的气体是V mL(标准状况时),由此计算出该废铁屑中铁的质量分数是
| V |
| 400m |
Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少
Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少
.(5)为了准确测定铁的质量分数,还可以另取mg废铁屑和某种常见的还原剂气体在加热时充分反应到恒重,测得实验后剩余固体质量是wg.由此求出铁的准确质量分数是
m-
| ||
| m |
m-
| ||
| m |