摘要:6.将下列物质.按要求填空:①水晶 ②白磷 ③晶体氩 ④氢氧化钾 ⑤干冰 ⑥硫磺⑦金刚石 ⑧过氧化钠 ⑨固体酒精 ⑴属于离子化合物的是 , ⑵属于分子晶体的单质是 .属于分子晶体的化合物是 , ⑶属于由原子直接构成的分子晶体的是 , ⑷属于原子晶体的是 , 专题二:化学反应与能量变化
网址:http://m.1010jiajiao.com/timu3_id_195134[举报]
“垃圾是放错地方的资源。”请你将下列生活垃圾按要求填在横线上。
①鱼骨 ②果皮 ③碎玻璃 ④废塑料 ⑤废旧金属制品 ⑥废报纸
(1)回收后可进行填埋处理的是(填写序号,下同)________________________________。
(2)回收后可再利用的是__________________________________________。
查看习题详情和答案>>“垃圾是放错地方的资源.”请你将下列生活垃圾按要求填在横线上.
①鱼骨
②果皮
③碎玻璃
④废塑料
⑤废旧金属制品
⑥废报纸
(1)回收后可进行填埋处理的是(填写序号,下同)________.
(2)回收后可再利用的是________.
下图为某些常见物质之间的转化关系.已知:A、B、I中含有相同的阳离子且都是XY2型化合物,且I是实验室常用的干燥剂;C为直线型分子;E、F为非金属气体单质.
请按要求填空:

(1)①B的电子式是
 ,②K的结构式是
,②K的结构式是
(2)D与G反应的化学方程式是
(3)已知C的燃烧热是1300kJ/mol,表示C的燃烧热的热化学方程式是
(4)将G溶于水配成溶液,简述检验该溶液G中所含阳离子的操作方法:
(5)常温下0.1mol/L的J溶液中c(H+)/c(OH-)=1×10-8,下列叙述错误的是
A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1mol/L的J溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH值为9;
(6)单质F在工业上有重要的用途是
查看习题详情和答案>>
请按要求填空:

(1)①B的电子式是


H-O-Cl
H-O-Cl
;(2)D与G反应的化学方程式是
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
;
| ||
(3)已知C的燃烧热是1300kJ/mol,表示C的燃烧热的热化学方程式是
C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol
| 5 |
| 2 |
C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol
;| 5 |
| 2 |
(4)将G溶于水配成溶液,简述检验该溶液G中所含阳离子的操作方法:
取少量的G溶液于试管中,加入适量的氢氧化钠溶液,加热试管,将湿润的红色石蕊试纸放在试管口,若试纸变成蓝色,则含有NH4+,(其他合理答案均给分)
取少量的G溶液于试管中,加入适量的氢氧化钠溶液,加热试管,将湿润的红色石蕊试纸放在试管口,若试纸变成蓝色,则含有NH4+,(其他合理答案均给分)
;(5)常温下0.1mol/L的J溶液中c(H+)/c(OH-)=1×10-8,下列叙述错误的是
BCE
BCE
;A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1mol/L的J溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH值为9;
(6)单质F在工业上有重要的用途是
制漂白粉,制盐酸(制漂白液等)
制漂白粉,制盐酸(制漂白液等)
.(至少两种)莫尔盐是硫酸盐的一种复盐,成分是(NH4)2Fe(SO4)2,它是一种重要的化学试剂,有如下反应:
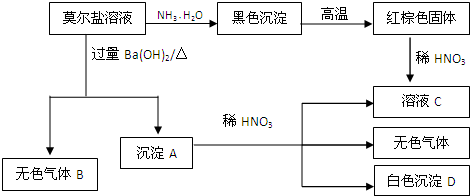
根据以上关系,按要求填空:
(1)气体B的电子式为 .红棕色固体F高温下和金属铝反应生成金属G的化学方程式为 .
(2)沉淀A与稀HNO3反应的离子方程式为 .
(3)与16.8g金属G恰好完全反应的稀HNO3溶解金属铜的物质的量x的范围为 .
(4)NH4HSO4是硫酸的一种酸式盐,向0.01mol/L NH4HSO4溶液中滴加NaOH溶液至中性,则c(Na+) c(SO42-),c(NH4+) c(SO42-)(填“>”,“<”或“=”)
(5)请将下列溶液中NH4+浓度由大到小排序
①0.02mol/L NH4HSO4 溶液
②0.01mol/L(NH4)2Fe(SO4)2溶液
③0.01mol/L(NH4)2 CO3溶液.
查看习题详情和答案>>

根据以上关系,按要求填空:
(1)气体B的电子式为
(2)沉淀A与稀HNO3反应的离子方程式为
(3)与16.8g金属G恰好完全反应的稀HNO3溶解金属铜的物质的量x的范围为
(4)NH4HSO4是硫酸的一种酸式盐,向0.01mol/L NH4HSO4溶液中滴加NaOH溶液至中性,则c(Na+)
(5)请将下列溶液中NH4+浓度由大到小排序
①0.02mol/L NH4HSO4 溶液
②0.01mol/L(NH4)2Fe(SO4)2溶液
③0.01mol/L(NH4)2 CO3溶液.
(1)已知拆开1mol H-H键、1mol I-I键、1mol H-I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘单质反应生成1mol HI需要
(2)下列五种物质中①Ne ②H2O ③NH3 ④KOH ⑤Na2O,只存在共价键的是
(3)按要求填空:
①推测Si、N 间氢化物的稳定性;
②C:
③3416S2-微粒中的质子数是
(4)对于反应2S02+02 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”).
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”).
查看习题详情和答案>>
放出
放出
(填“放出”或“吸收”)5.5
5.5
kJ的热量.氢气、碘单质和碘化氢三种分子最稳定的是H2
H2
.(2)下列五种物质中①Ne ②H2O ③NH3 ④KOH ⑤Na2O,只存在共价键的是
②③
②③
,只存在离子键的是⑤
⑤
,既存在共价键又存在离子键的是④
④
,不存在化学键的是①
①
.(填写序号)(3)按要求填空:
①推测Si、N 间氢化物的稳定性;
NH3
NH3
>SiH4
SiH4
(填化学式) ②C:
二
二
周期IVA
IVA
族;③3416S2-微粒中的质子数是
16
16
,中子数是18
18
,核外电子数是18
18
.(4)对于反应2S02+02
 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”).
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”).