摘要:7.下列11种物质⑴ 生石灰 ⑵ 铜绿 ⑶ 干冰 ⑷ Na2O2 ⑸ NO2 ⑹ SiO2 ⑺ Fe(OH)3胶体 ⑻ 煤 ⑼ 石灰水⑽ 小苏打 ⑾ 汽油 其中①属于混合物的是 ②属于盐类的是 ③属于酸性氧化物的是 ④属于碱性氧化物的是 [能力提高]
网址:http://m.1010jiajiao.com/timu3_id_195029[举报]
现有下列11种物质,请按要求回答问题:
(1)豆浆
(2)锌
(3)氧化铁
(4)碳
(5)盐酸
(6)氢氧化钠
(7)氯化钡
(8)氢氧化铁浊液
(9)硝酸
(10)四氯化碳
(11)碳酸钠
Ⅰ.运用树状分类法将上述物质进行分类(能用化学式表示的写化学式),要求分至最基本的类型.(参考下图,逐级分类,将上述物质填在图中最底层,中间层次的横线上写物质的类别)

Ⅱ.粗盐水中含可溶性杂质(钙盐、镁盐、硫酸盐),现进行提纯以获得纯净的食盐水.
请在Ⅰ的物质中选择合适的试剂按以下流程进行除杂,并回答有关问题.
粗盐水![]()
![]()
![]()
![]() 纯净的食盐水
纯净的食盐水
(1)步骤③所发生的化学反应方程式为:________
(2)操作A的名称是________
(3)步骤④加入的试剂及用量是________,若未进行操作A就加该试剂再产生的结果是________.
(4)步骤③所加试剂应该是过量的,判断该试剂过量的方法是:________,________,若不再产生沉淀,则说明该试剂已经过量.
25℃时,电离平衡常数:
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是:
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是:
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)?c(OH-) D.c(OH-)/c(H+)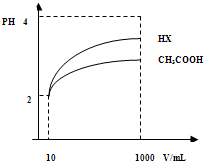
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.则HX的电离平衡常数
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO-)-c(Na+)=
查看习题详情和答案>>
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
3.0×10-8 |
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是:
a>b>d>c
a>b>d>c
;(填编号)(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是:
A
A
;A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)?c(OH-) D.c(OH-)/c(H+)

(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.则HX的电离平衡常数
大于
大于
(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是HX的pH变化程度大,则酸性HX强,电离平衡常数大
HX的pH变化程度大,则酸性HX强,电离平衡常数大
,稀释后,HX溶液中水电离出来的c(H+)大于
大于
醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小
稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小
;(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO-)-c(Na+)=
9.9×10-7mol/L
9.9×10-7mol/L
.(填准确数值).本题为选做题.包括A、B两题.选学《化学与生活》模块的考生答A题.选学《有 机化学基础》模块的考生答B题.每位考生只可选做1题.若两题都作答.则以A题计分.
A.《化学与生活》
(1)现有下列五种物质:(a)食盐 (b)食醋 (c)苹果汁 (d)葡萄糖 (e)青霉素,请按下列要求填空(填序号).
富含维生素C的是
(2)防治环境污染,改善生态环境已成为全球的共识.
①空气质量报告的各项指标可以反映出各地空气的质量.下列气体已纳入我国空气质量报告的是
a.CO2 b.N2 c.NO2
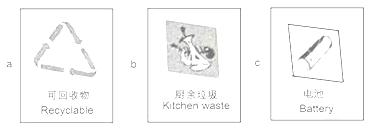
②垃圾应分类收集.导致“白色污染”的生活垃圾应放置于贴有
③工业废水需处理达标后才能排放.下列废水处理的方法合理的是
a.用中和法除去废水中的酸
b.用混凝剂除去废水中的重金属离子
c.用氯气除去废水中的悬浮物
(3)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础.请填写下列空格.
①生活中的陶瓷、水泥和
②在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点
③下列对金属制品采取的防护方法不正确的是
A.在电线的外面包上一层塑料层 B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
(4)某肉制品包装上印有相关配料:精选瘦肉、食盐、亚硝酸钠、苯甲酸钠.其中属于调味剂的是
B.《有机化学基础》(我校学生统一不选做)
(1)(3分)根据结构对有机物进行分类,有助于对其性质的掌握.
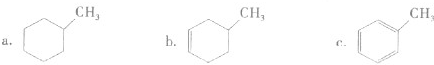
①下列有机物属于芳香烃的是
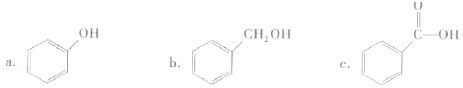
②下列有机物属于酚类的是
③下列有机物属于糖类的是
a.油脂 b.纤维素 c.蛋白质
(2)化合物X的结构简式为: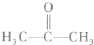
①X的核磁共振氢谱图(H核磁共振谱图)上有
②X的一种同分异构体Y能发生银镜反应,请写出Y的结构简式:
③X的另一种同分异构体z的结构简式为H2C═CHCH2OH,请写出Z与Br2发生加成反应的化学方程式:
(3)2010年上海世博会充分体现了绿色生活理念,节能环保材料在园区内随处可见.如一次性餐盒是由一种生物可降解的高分子合成材料制得.其结构简式如下: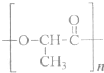
①该高分子材料是由一种单体通过
 .
.
②若两分子的该单体发生反应,既可能得到环状化合物M,也可能得到链状化合物N.其结构简式如下:
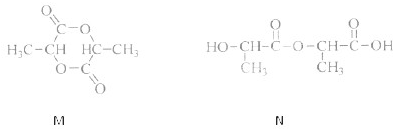
请用两种方法鉴别M和N.方法一:
查看习题详情和答案>>
A.《化学与生活》
(1)现有下列五种物质:(a)食盐 (b)食醋 (c)苹果汁 (d)葡萄糖 (e)青霉素,请按下列要求填空(填序号).
富含维生素C的是
c
c
;可直接进入血液补充能量的是d
d
;应用最广泛的抗生素之一的是e
e
;即可作为调味剂,又可预防感冒的是b
b
;食用过多会引起血压升高、肾脏受损的a
a
.(2)防治环境污染,改善生态环境已成为全球的共识.
①空气质量报告的各项指标可以反映出各地空气的质量.下列气体已纳入我国空气质量报告的是
C
C
(填字母).a.CO2 b.N2 c.NO2
②垃圾应分类收集.导致“白色污染”的生活垃圾应放置于贴有
a
a
(填字母)标志的垃圾筒内.
③工业废水需处理达标后才能排放.下列废水处理的方法合理的是
a
a
(填字母).a.用中和法除去废水中的酸
b.用混凝剂除去废水中的重金属离子
c.用氯气除去废水中的悬浮物
(3)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础.请填写下列空格.
①生活中的陶瓷、水泥和
玻璃
玻璃
属于传统无机硅酸盐材料,其中生产不需要用石灰石作原料的是陶瓷
陶瓷
.②在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点
低
低
(填“高”或“低”).③下列对金属制品采取的防护方法不正确的是
C
C
(填序号).A.在电线的外面包上一层塑料层 B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
(4)某肉制品包装上印有相关配料:精选瘦肉、食盐、亚硝酸钠、苯甲酸钠.其中属于调味剂的是
食盐
食盐
,属于发色剂的是亚硝酸钠
亚硝酸钠
,属于防腐剂的是苯甲酸钠
苯甲酸钠
.B.《有机化学基础》(我校学生统一不选做)
(1)(3分)根据结构对有机物进行分类,有助于对其性质的掌握.
①下列有机物属于芳香烃的是
c
c
(填字母).
②下列有机物属于酚类的是
a
a
(填字母).
③下列有机物属于糖类的是
b
b
(填字母).a.油脂 b.纤维素 c.蛋白质
(2)化合物X的结构简式为:

①X的核磁共振氢谱图(H核磁共振谱图)上有
1
1
个吸收峰.②X的一种同分异构体Y能发生银镜反应,请写出Y的结构简式:
CH3-CH2-CHO
CH3-CH2-CHO
.③X的另一种同分异构体z的结构简式为H2C═CHCH2OH,请写出Z与Br2发生加成反应的化学方程式:
H2C═CHCH2OH+Br2=H2CBrCHBrCH2OH
H2C═CHCH2OH+Br2=H2CBrCHBrCH2OH
.(3)2010年上海世博会充分体现了绿色生活理念,节能环保材料在园区内随处可见.如一次性餐盒是由一种生物可降解的高分子合成材料制得.其结构简式如下:
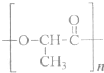
①该高分子材料是由一种单体通过
缩聚
缩聚
反应(填反应类型)制备而成,其单体的结构简式为

②若两分子的该单体发生反应,既可能得到环状化合物M,也可能得到链状化合物N.其结构简式如下:
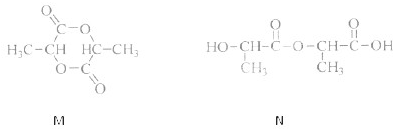
请用两种方法鉴别M和N.方法一:
取两种产物分别加入Na2CO3溶液.有气体生成的是N,无气体生成的是M
取两种产物分别加入Na2CO3溶液.有气体生成的是N,无气体生成的是M
;方法二:取两种产物分别做核磁共振氢谱(1H核磁共振),谱图上出现2组峰的是M,出现6组峰的是N
取两种产物分别做核磁共振氢谱(1H核磁共振),谱图上出现2组峰的是M,出现6组峰的是N
.现有下列几种物质:(1)铝 (2)石墨 (3)氢氧化钠 (4)BaSO4晶体 (5)H2SO4 (6)CO2 (7)食盐水 (8)乙醇 (9)熔化的KNO3 (10)泥浆水 (11)淀粉溶液 (12)氧化镁,请用编号填写下列空格:
(1)按物质的组成分类,属于单质的是
(2)属于分散系的有
(3)直接能导电的电解质是
查看习题详情和答案>>
(1)按物质的组成分类,属于单质的是
(1)(2)
(1)(2)
,属于盐的是(4)(9)
(4)(9)
.(2)属于分散系的有
(7)(10)(11)
(7)(10)(11)
,其中属于胶体的有(11)
(11)
.(3)直接能导电的电解质是
(9)
(9)
.化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)已知可逆反应FeO(s)+CO(g)?Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如右表:
①写出该反应平衡常数的表达式
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的平均相对分子质量
(2)常温下,浓度均为0.1mol?L-1的下列六种溶液的pH如下表:
①上述盐溶液中的阴离子,结合质子能力最强的是
②根据表中数据判断,浓度均为0.01mol?L-1的下列五种物质的溶液中,酸性最强的是
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(3)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里c(Cu2+)=0.02mol?L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于
查看习题详情和答案>>
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
①写出该反应平衡常数的表达式
K=
| c(CO2) |
| c(CO) |
K=
.| c(CO2) |
| c(CO) |
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的平均相对分子质量
减小
减小
(选填“增大”、“减小”、“不变”);充入氦气,混合气体的密度增大
增大
(选填“增大”、“减小”、“不变”).(2)常温下,浓度均为0.1mol?L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
CO32-
CO32-
②根据表中数据判断,浓度均为0.01mol?L-1的下列五种物质的溶液中,酸性最强的是
D
D
(填编号);将各溶液分别稀释100倍,pH变化最小的是C
C
(填编号).A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是
CD
CD
(填编号).A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
H++HCO3-=H20+CO2↑
H++HCO3-=H20+CO2↑
(3)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里c(Cu2+)=0.02mol?L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于
5
5
;要使0.2mol?L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH为6
6
.