摘要:(二)元素周期表的结构 1. 元素周期表的含义及编排原则 编排原则:将元素按原子序数递增由小到大的顺序排列.将原子电子层数相同的元素从左到右排成一横行,将不同横行中原子的最外层电子数的相同的元素按电子层数递增的顺序排成一纵行.这样得到的表叫元素周期表. 关系:元素周期表是元素周期律的具体表示形式. 2. 元素周期表的结构 (1)周期 (2)族 (3)格 元素周期表由若干个格组成.以Ag元素所在的格为例,指出每个格内都标出了哪些信息: 原子序数.元素符号.元素名称.元素的相对原子质量等. (4)区 找出元素周期表中金属元素区域与非金属元素区域的分界线.指出不同区域元素表现出来的性质: 左侧金属元素表现出:金属性,右侧非金属元素表现出:非金属性, 分界线附近元素表现出:既表现出一定的金属性.又表现出一定的非金属性 . (5)系 镧系:从57号元素镧原子结构和元素化学性质十分相似.这15种元素总称为镧系元素. 锕系:从89号元素锕原子结构和元素化学性质十分相似.这15种元素总称为锕系元素. 3. 元素周期表与原子结构的关系 (1)在同一周期内的元素.分析原子结构的变化规律:同周期.随着原子序数的递增.原子最外层电子数从1递增到2或8. (2)在同一主族内的元素.原子结构的变化规律:同主族元素.原子的最外层电子数相同.随着原子序数的增大.电子层数递增. 几条重要规律: ①周期的序数=电子层数 ②主族的序数=原子最外层电子数 ③非金属元素最高价和最底价的绝对值之和等于8 ④原子序数=质子数=核电荷数 ⑤副族和Ⅷ族最外层只有1-2个电子,最外层电子数是次外层电子数的2倍或3倍的元素.位于2周期,次外层电子数是8的元素位于3 周期和第IA .IIA族(其中H. Li.Be除外) 归纳:原子半径.离子半径的大小如何判断? (1)同周期原子半径:随着原子序数的递增.原子半径依次减小. 同周期阴离子半径:随着原子序数的递增.阴离子半径依次减小. 同周期阳离子半径:随着原子序数的递增.阳离子半径依次减小. 例如:Na > Mg > Al > Si , Na+ < Mg2+ < Al3+ ,P >S > Cl , S2- >Cl – (2)同主族原子半径:随着电子层数的递增.半径增大. 同主族阳离子半径:随着电子层数的递增.半径增大. 同主族阴离子半径:随着电子层数的递增.半径增大. 例:Li < Na < K < Rb < Cs ,F< Cl < Br< I ,Li + < Na+ < K+ < Rb+ < Cs+ ,F- < Cl- < Br- < I- (3)同种元素的原子半径大于阳离子半径.而小于阴离子半径. 例:Fe > Fe2+ >Fe3+, Na > Na+, S <S2- (4)电子层结构相同的离子半径:核电荷数越大.半径越小. 例:O2- > F->Na+ > Mg2+ > Al3+
网址:http://m.1010jiajiao.com/timu3_id_194636[举报]
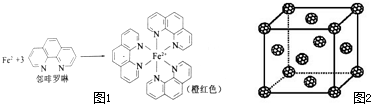 元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值.
元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值.(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰.相关的反应如下:
4FeCl3+2NH2OH?HCl→4FeCl2+N2O↑+6HCl+H2O
①Fe2+在基态时,核外电子排布式
②羟胺中(NH2OH)采用SP3杂化的原子有
③Fe2+与邻啡罗啉形成的配合物中,配位数为
(2)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体,该晶体中含有的化学键类型是
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+,已知NF3与NH3的空间构型都是三角锥形,但NF3 不易与Cu2+形成配离子,其原因是
(4)配合物Ni(CO)4常温下呈液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于
(5)如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周 期电负性最小的原子可作为容体掺入C60 晶体的空隙中,形成具有良好的超导性的掺杂C60 化合物.现把C60抽象成质点,该晶体的晶胞结构如图2所示,若每个四面体空隙填入一个原子,则全部填满C60 晶体的四面体空隙后,所形成的掺杂C60 化合物的化学式为
元素周期表反映了元素性质的周期性变化规律.请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1)短周期元素中,原子最外层电子数和电子层数相等的元素有 种.
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中E的化学式为 ;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为 .
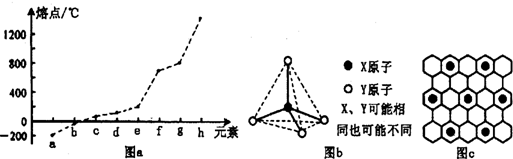
(3)原子半径最小的元素与第二周期的两种元素可形成分子甲和离子乙.分子甲和离子乙含有相等的电子数,且乙的立体结构如图b所示.请写出甲、乙反应的离子方程式: .
(4)第二、第三周期的某些元素中能形成具有图b所示的结构单元的单质丙和化合物丁,丙和丁的晶体类型相同,写出丙与丁在高温时发生反应的化学方程式 .
(5)元素丙的某种单质具有平面层状结构,同一层中的原子构成许许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图C所示,该物质的化学式为 .
查看习题详情和答案>>
(1)短周期元素中,原子最外层电子数和电子层数相等的元素有
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中E的化学式为

| 氢化物 | A | B | C | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | -33 | -162 |
(4)第二、第三周期的某些元素中能形成具有图b所示的结构单元的单质丙和化合物丁,丙和丁的晶体类型相同,写出丙与丁在高温时发生反应的化学方程式
(5)元素丙的某种单质具有平面层状结构,同一层中的原子构成许许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图C所示,该物质的化学式为
元素周期表时学习化学的工具,也为化学的进一步探索与研究提供理论指导,化学学习者和研究者一直关注周期表的运用和发展.试回答下列问题:
(1)2006年11月16日美国和俄罗斯科学家联合宣布,他们合成出了118号元素,新原子的质量数为297,则该新原子中子数与质子数之差为
(2)人们研究发现第一周期与第二周期一些元素性质与同族元素性质共性很少,有人建议将氢放在ⅦA,写出一种能支持该观点的化合物: ,人们发现Li+溶剂化倾向和形成共价键倾向很强,提出类似氢键的“锂键”,请写出(LiF)2含锂键的结构式:
(3)研究周期表发现存在对角线规则,处在对角线上的元素性质相似,如硼和硅处于对角线,请写出硼和氢氧化钠溶液反应的离子方程式: .
查看习题详情和答案>>
(1)2006年11月16日美国和俄罗斯科学家联合宣布,他们合成出了118号元素,新原子的质量数为297,则该新原子中子数与质子数之差为
(2)人们研究发现第一周期与第二周期一些元素性质与同族元素性质共性很少,有人建议将氢放在ⅦA,写出一种能支持该观点的化合物:
(3)研究周期表发现存在对角线规则,处在对角线上的元素性质相似,如硼和硅处于对角线,请写出硼和氢氧化钠溶液反应的离子方程式:
元素周期表反映了元素性质的周期性变化规律,请根据短周期元素在周期表中的位置、结构和相关性质并结合所提供图表,回答下列问题:
(1)短周期元素中,原子的最外层电子数与电子层数相等的元素有 种.
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如上表所示,其中A的晶体类型是 ,C的化学式为 .
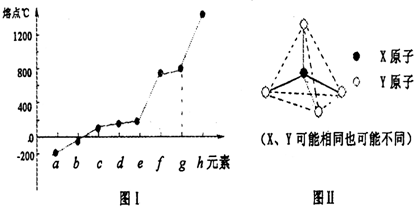
(3)第三周期元素单质的熔点变化如图Ⅰ所示,则g元素的名称为 ,h的元素符号是 .
(4)分子甲和离子乙都含有10个电子,且离子乙的立体结构如图Ⅱ所示.写出甲、乙反应的离子方程式 .请再写出一种由短周期元素组成的,结构如图Ⅱ的分子的化学式 .
查看习题详情和答案>>

| 氢化物 | 沸点℃ |
| A | 1317 |
| B | 100 |
| C | 19.5 |
| D | -33 |
| E | -162 |
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如上表所示,其中A的晶体类型是
(3)第三周期元素单质的熔点变化如图Ⅰ所示,则g元素的名称为
(4)分子甲和离子乙都含有10个电子,且离子乙的立体结构如图Ⅱ所示.写出甲、乙反应的离子方程式
元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1)短周期元素中,原子最外层电子数和电子层数相等的元素有________种。
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表1所示,其中C的化学式为________________;第三周期元素单质的熔点(℃)变化如下图Ⅰ所示,其中h的元素符号为________________。
氢化物 | 沸点/℃ |
A | 1 317 |
B | 100 |
C | 19.5 |
D | -33 |
E | -162 |
表1

图Ⅰ
(3)原子半径最小的元素与第二周期的两种元素可分别形成分子甲和离子乙。分子甲和离子乙含有相等的电子数,且乙的立体结构如图Ⅱ所示。请写出甲、乙反应的离子方程式_________________。

(X、Y可能相同也可能不同)
图Ⅱ
(4)第二、第三周期的某些元素中能形成具有图Ⅱ所示的结构单元的单质丙和化合物丁,丙和丁的晶体类型相同,且丙与丁在高温时能发生置换反应。若该反应中丙被破坏了1 mol共价键,则参加反应的丁的质量为__________g。
查看习题详情和答案>>