摘要:I中品红褪色,(3)除去SO2,(4)检验SO2是否除尽,(5)III中品红溶液不褪色.IV中酸性KMnO4溶液褪色
网址:http://m.1010jiajiao.com/timu3_id_194521[举报]
实验室制取乙烯常因温度过高生成少量SO2,有人设计了下列实验以验证上述混合气体中含有乙烯和SO2。
(1)如图5-4,A、B、C、D装置中可盛放的试剂是(填序号):
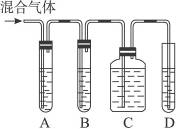
图5-4
A. ________________;B. ________________;C. ________________;D. ________________。
①品红溶液 ②NaOH溶液 ③溴水 ④KMnO4酸性溶液
(2)能说明SO2气体存在的现象是___________________________。
(3)使用装置B的目的是__________________。
(4)使用装置C的目的是__________________。
(5)确定含有乙烯的现象是__________________。
查看习题详情和答案>>四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z原子与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1.
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,a的分子式是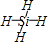
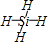 ;中心原子的杂化轨道类型分别是
;中心原子的杂化轨道类型分别是
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)
(4)Y与Z比较,电负性较大的是
(5)W的元素符号是
查看习题详情和答案>>
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,a的分子式是
CH4
CH4
,b的结构式是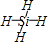
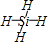
sp3
sp3
、sp3
sp3
;a分子的立体结构是正四面体
正四面体
;(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是
分子
分子
晶体、原子
原子
晶体;(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)
CO2
CO2
;(4)Y与Z比较,电负性较大的是
C
C
;(5)W的元素符号是
Zn
Zn
,其+2价离子的核外电子排布式是1s22s22p63s23p63d10
1s22s22p63s23p63d10
.短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13.B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素.试回答以下问题:
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:
 .F的原子结构示意图为
.F的原子结构示意图为
 .
.
(2)B、D形成的化合物BD2中存在的化学键为
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性.则甲、乙反应的离子方程式为
(4)A、C、D、E的原子半径由大到小的顺序是
(5)元素B和F的非金属性强弱,B的非金属性
查看习题详情和答案>>
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:




(2)B、D形成的化合物BD2中存在的化学键为
共价
共价
键(填“离子”或“共价”,下同).A、C、F三种元素形成的化合物CA4F为离子
离子
化合物.(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性.则甲、乙反应的离子方程式为
OH-+HCO3-═CO32-+H2O
OH-+HCO3-═CO32-+H2O
.(4)A、C、D、E的原子半径由大到小的顺序是
Na>N>O>H
Na>N>O>H
(用元素符号表示).(5)元素B和F的非金属性强弱,B的非金属性
弱
弱
于F(填“强”或“弱”),并用化学方程式证明上述结论Na2CO3+2HClO4═CO2↑+H2O+2NaClO4
Na2CO3+2HClO4═CO2↑+H2O+2NaClO4
. 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:(1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是
B
B
(填”A”或”B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1<
<
m2.(选填”<“、”=“或”>“)(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).该反应的平衡常数表达式K=
| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
减小
减小
(填”增大”“减小”或”不变”).在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=| 2nB |
| 3tB |
| 2nB |
| 3tB |
(3)难溶电解质在水溶液中存在着溶解平衡.在某温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:Mg(OH)2(s)?Mg2+ (aq)+2OH- (aq),某温度下Ksp=c(Mg2+)[c(OH-)]2=2×10-11.若该温度下某MgSO4溶液里c(Mg2+)=0.002mol?L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于
10
10
;该温度下,在0.20L的0.002mol?L-1MgSO4溶液中加入等体积的0.10mol?L-1的氨水溶液,该温度下电离常数K(NH3?H2O)=2×10-5,经计算有
有
(填”有”或”无”)Mg(OH)2沉淀生成.(4)常温下,向某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈
碱
碱
性.在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中Na2CO3电离出的C| O | 2- 3 |
X、Y、Z、W、M五种元素的原子序数依次增大.已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍. M是地壳中含量最高的金属元素.
回答下列问题:
(1)M在元素周期表中的位置为
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,A的电子式为
 ,B的结构式为
,B的结构式为
 .
.
(3)硒(Se)是人体必需的微量元素,与W同一主族,Se原子比W原子多两个电子层,则Se的原子序数为
a.+99.7kJ?mol-1 b.+29.7kJ?mol-1
c.-20.6kJ?mol-1 d.-241.8kJ?mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q.写出阳极生成R的电极反应式:
查看习题详情和答案>>
回答下列问题:
(1)M在元素周期表中的位置为
第3周期第ⅢA族
第3周期第ⅢA族
;五种元素的原子半径从大到小的顺序是Al>C>N>O>H
Al>C>N>O>H
(用元素符号表示).(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,A的电子式为




(3)硒(Se)是人体必需的微量元素,与W同一主族,Se原子比W原子多两个电子层,则Se的原子序数为
34
34
,其最高价氧化物对应的水化物化学式为H2SeO4
H2SeO4
,该族2~5周期元素单质分别与H2反应生成1mol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是b
b
(填字母代号).a.+99.7kJ?mol-1 b.+29.7kJ?mol-1
c.-20.6kJ?mol-1 d.-241.8kJ?mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q.写出阳极生成R的电极反应式:
Al-3e-+HCO3-═Al(OH)3↓+3CO2↑
Al-3e-+HCO3-═Al(OH)3↓+3CO2↑
.