摘要:甲方案不严密.若原溶液含.同样有同样现象. 乙方案可行先加盐酸.证明不含.再证明加出白色沉淀定有产生. 4.灼烧出.可以都有.如酸全溶.说明不含.含.有没有不影响实验现象 答案.肯定无.肯定有和C 2 + 不肯定 取少量样品滴加稀盐酸.放出使澄清石灰水变混的气体 +
网址:http://m.1010jiajiao.com/timu3_id_194215[举报]
在如图用石墨作电极的电解池中,放入500 mL含一种溶质的某蓝色硫酸盐溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成.请回答下列问题:
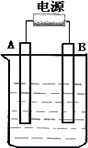
(1)请写出B极板的名称:________ 电极反应式________.
写出电解时反应的总离子方程式________.
(2)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6 g.电解后溶液的pH为________;要使电解后溶液恢复到电解前的状态,则需加入________,其质量为________g.(假设电解前后溶液的体积不变)
(3)若原溶液为1 L K2SO4、CuSO4的混合溶液,且c(SO42-)=2.0 mol/L;如图装置电解,当两极都收集到22.4 L气体(标准状况)时,停止电解.
则原溶液中的c(K+)=________.
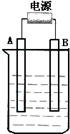 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成.请回答下列问题:(1)请写出B极板的名称及反应式:
(2)写出电解时反应的总离子方程式
(3)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.电解后溶液的pH为
(4)若原溶液为1L K2SO4、CuSO4的混合溶液,且c(SO42-)=2.0mol/L;如图装置电解,当两极都收集到22.4L气体(标准状况)时,停止电解.则原溶液中的c(K+)为多少?(请简单表示计算过程)
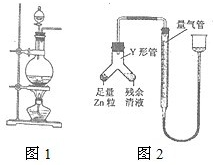 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).(1)制备实验开始时,先检查装置气密性,接下来的操作依次是
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
制备反应会因盐酸浓度下降而停止.为测定已分离出过量MnO2后的反应残余液中盐酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量.
乙方案:与已知量CaCO3(过量)反应,称量剩余固体的质量.
丙方案:与足量Zn反应,测量生成的H2体积.
继而进行下列判断和实验:
(2)判定甲方案不可行,理由是
(3)乙方案的实验发现,固体中含有MnCO3,说明碳酸钙在水中存在
进行丙方案实验:装置如图2所示(夹持器具已略去).
(4)使Y形管中的残余清液与锌粒反应的正确操作是将
(5)反应完毕,每间隔1分钟读取气体体积,发现气体体积逐渐减小,直至不变.气体体积逐次减小的原因是
(排除装置和实验操作的影响因素).
(6)小组内又有同学提出还可采用酸碱中和滴定法测定残余液中盐酸的浓度,但还需经查阅资料知道:
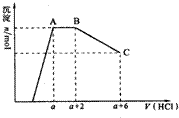 某10mL溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,向溶液中逐滴加入1mol/L的盐酸,生成沉淀物质的量与加入盐酸体积的关系如图所示,下列说法中正确的是( )
某10mL溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,向溶液中逐滴加入1mol/L的盐酸,生成沉淀物质的量与加入盐酸体积的关系如图所示,下列说法中正确的是( )| A、原溶液肯定含有OH-,CO32-,AlO2-,SiO32-,Na+ | ||
B、若原溶液中只含有某一种阳离子(不考虑水电离出引厂来的氢离子)且忽略反应前后溶液体积变化,那么该离子在原溶液中的物质的量浓度为
| ||
| C、n(CO32-):n(AlO2-)=3:4 | ||
| D、a值肯定等于4 |
已知几种离子的还原能力强弱顺序为I->Fe2+>Br-,现有200mL混合溶液中含FeI2、FeBr2各0.10mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其他反应)
(1)若氯水中有0.15mol Cl2被还原,则所得溶液中含有的阴离子主要是
(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为
(3)通过对上述反应的分析,试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是
(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸),试写出此反应的离子方程式:
查看习题详情和答案>>
(1)若氯水中有0.15mol Cl2被还原,则所得溶液中含有的阴离子主要是
Br-、Cl-
Br-、Cl-
,剩余Fe2+的物质的量为0.1mol
0.1mol
.(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为
0.25mol
0.25mol
,若最终所得溶液为400mL,溶液中主要阳离子及其物质的量浓度为0.5mol/L
0.5mol/L
.(3)通过对上述反应的分析,试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是
Cl2>Br2>Fe3+>I2
Cl2>Br2>Fe3+>I2
.(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸),试写出此反应的离子方程式:
5Cl2+I2+6H2O=2 IO3-+12H++10Cl-
5Cl2+I2+6H2O=2 IO3-+12H++10Cl-
,上述所有反应共消耗Cl20.8
0.8
mol.