网址:http://m.1010jiajiao.com/timu3_id_194176[举报]
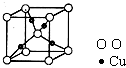 [化学--物质结构与性质]
[化学--物质结构与性质]第4周期过渡金属元素能形成多种多样的配合物.CO可以和过渡金属形成配合物.
(1)Fe3+离子的电子排布式为
(2)一般地说,第4周期元素的第一电离能随原子序数的增大而增大,而31Ga的第一电离能却明显低于30Zn,原因是
(3)下表为CO和N2的有关信息.根据表中数据,说明CO比N2活泼的原因:
| 化学键 | C-O | C═O | C≡O |
| 键能(kJ/mol) | 351 | 803 | 1071 |
| 化学能 | N-N | N═N | N≡N |
| 键能(kj/mol) | 159 | 418 | 945 |
乙醛是重要的化工原料。目前工业上使用两种方法制取乙醛
(1)乙炔水化法: CH≡CH+H2O![]() CH3CHO
CH3CHO
(2)乙烯氧化法: CH2=CH2 + O2 ![]() CH3CHO
CH3CHO
有关信息为
| 物质 项目 | 乙炔水化法 | 乙烯氧化法 |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4(催化剂) 100℃~125℃ | PdCl2~CuCl2(催化剂) 100℃~125℃ |
| 平衡转化率 | 乙炔转化率 90% | 乙烯转化率 80% |
| 反应速率 | 较 慢 | 较 快 |
| 原料来源生产工艺 | CaCO3 CaC2 | 石油裂解气 |
(1)实验室用乙醇氧化制乙醛的化学方程式_______________________ ;
(2)乙醛与新制Cu(OH)2反应的化学方程式_____________________________ 。
(3)某裂解气中各成分的体积分数分别为:甲烷5%、乙烯40%、丙烯10%、丁二烯(C4H6)10%、氢气35 % ,将其通入溴水充分反应,干燥后剩余气体的平均相对分子质量为____________(精确到0.01)。
查看习题详情和答案>>乙醛是重要的化工原料。目前工业上使用两种方法制取乙醛
(1)乙炔水化法: CH≡CH+H2O![]() CH3CHO
CH3CHO
(2)乙烯氧化法: CH2=CH2 + O2 ![]() CH3CHO
CH3CHO
有关信息为
| 物质 项目 | 乙炔水化法 | 乙烯氧化法 |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4(催化剂) 100℃~125℃ | PdCl2~CuCl2(催化剂) 100℃~125℃ |
| 平衡转化率 | 乙炔转化率 90% | 乙烯转化率 80% |
| 反应速率 | 较 慢 | 较 快 |
| 原料来源生产工艺 | CaCO3 CaC2 | 石油裂解气 |
(1)实验室用乙醇氧化制乙醛的化学方程式_______________________ ;
(2)乙醛与新制Cu(OH)2反应的化学方程式_____________________________ 。
(3)某裂解气中各成分的体积分数分别为:甲烷5%、乙烯40%、丙烯10%、丁二烯(C4H6)10%、氢气35 % ,将其通入溴水充分反应,干燥后剩余气体的平均相对分子质量为____________(精确到0.01)。
查看习题详情和答案>>合成氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氮气直接合成氨,制得的氨通过催化氧化可生产硝酸。
在一定条件下,若N2和H2以体积比1:3的比例充入一体积不变的密闭容器中反应,达到平衡状态时,测得混合气体中氨的体积分数为20.0%,则:
(1)合成氨反应达到平衡的标志 ▲ 。
A.容器内气体压强保持不变
B.容器内各物质的浓度不随时间变化
C.当υ(H2,正)=0.3mol·L-1·min-1,υ(NH3,逆)=0.2mol·L-1·min-1时
D.1个N≡N键断裂的同时,有3个H-H键形成
(2)达到平衡时,N2和H2的转化率分别为 ▲ 。
(3)用氨催化氧化可生产硝酸,取所生产的硝酸溶液100mL,与足量的铜反应,生成的NO2和NO混合气体在标准状况下体积为6.72L,物质的量之比为2:1,求所生产硝酸的物质的量浓度?(请写出该小题的计算过程)
▲ 。
(4)某厂用NH3生产硝酸,然后再制硝酸铵,其过程如下:
![]()
其中反应②为:4NO+3O2+2H2O![]() 4HNO3,原料气为氨气和空气的混合物。
4HNO3,原料气为氨气和空气的混合物。
若实际生产中,反应①、②、③的转化率(或利用率)分别为a、b、c,则生产硝酸的氨气占所用氨气总量的体积分数为 ▲ 。
查看习题详情和答案>>