题目内容
 [化学--物质结构与性质]
[化学--物质结构与性质]第4周期过渡金属元素能形成多种多样的配合物.CO可以和过渡金属形成配合物.
(1)Fe3+离子的电子排布式为
1s22s22p63s23p63d5
1s22s22p63s23p63d5
.配合物Fe(CO)5的配位体是CO
CO
.常温下,Fe(CO)5为黄色液体,易溶于非极性溶剂,熔点为251K,沸点为376K,据此,可判断Fe(CO)5晶体属于分子
分子
晶体(填“离子”、“原子”、“分子”或“金属”).CO和N2的价电子总数相同,CO和N2相似,分子中都存在一个共价叁键,其中包含1
1
个δ键,2
2
个π键.(2)一般地说,第4周期元素的第一电离能随原子序数的增大而增大,而31Ga的第一电离能却明显低于30Zn,原因是
Zn原子的价电子排布式为3d104s2,体系的能量较低,原子较稳定,故Zn的第一电离能大于Ga
Zn原子的价电子排布式为3d104s2,体系的能量较低,原子较稳定,故Zn的第一电离能大于Ga
.(3)下表为CO和N2的有关信息.根据表中数据,说明CO比N2活泼的原因:
CO中第一个π键的键能比N2的第一个π键的键能小很多,CO的第一个π键容易断裂
CO中第一个π键的键能比N2的第一个π键的键能小很多,CO的第一个π键容易断裂
.| 化学键 | C-O | C═O | C≡O |
| 键能(kJ/mol) | 351 | 803 | 1071 |
| 化学能 | N-N | N═N | N≡N |
| 键能(kj/mol) | 159 | 418 | 945 |
4
4
.分析:(1)可根据Fe的电子排布式书写Fe3+离子的电子排布式,配合物Fe(CO)5的配位体是CO,能提供孤对电子,根据物质的物理性质判断晶体的类型,共价叁键中含有1个δ键,2个π键;
(2)根据价电子排布判断电离能的大小;
(3)物质的活泼性取决于键能的大小;
(4)利用均摊法计算晶胞.
(2)根据价电子排布判断电离能的大小;
(3)物质的活泼性取决于键能的大小;
(4)利用均摊法计算晶胞.
解答:解:(1)Fe的原子序数为26,根据能量最低原理课写出Fe基态原子的电子排布式为1s22s22p63s23p63d64s2,则Fe3+离子的电子排布式为1s22s22p63s23p63d5,CO具有孤对电子,配合物Fe(CO)5的配位体是CO,为黄色液体,易溶于非极性溶剂,熔点为251K,沸点为376K,说明为分子晶体,共价叁键中含有1个δ键,2个π键,
故答案为:1s22s22p63s23p63d5; CO;分子;1;2;
(2)Zn原子的价电子排布式为3d104s2,价电子中3d、4s轨道为全充满状态,原子较稳定,故Zn的第一电离能大于Ga,
故答案为:Zn原子的价电子排布式为3d104s2,体系的能量较低,原子较稳定,故Zn的第一电离能大于Ga;
(3)由表中数据可知:C≡O→C═O,需吸收1071kJ-803kJ=268kJ能量,N≡N→N═N,需吸收945kJ-418kJ=427kJ能量,
CO中第一个π键的键能比N2的第一个π键的键能小很多,CO的第一个π键容易断裂,说明CO比N2活泼.
故答案为:CO中第一个π键的键能比N2的第一个π键的键能小很多,CO的第一个π键容易断裂;
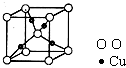
(4)由晶胞结构可知,Cu位于晶胞内部,则一个晶胞含有4个Cu,故答案为:4.
故答案为:1s22s22p63s23p63d5; CO;分子;1;2;
(2)Zn原子的价电子排布式为3d104s2,价电子中3d、4s轨道为全充满状态,原子较稳定,故Zn的第一电离能大于Ga,
故答案为:Zn原子的价电子排布式为3d104s2,体系的能量较低,原子较稳定,故Zn的第一电离能大于Ga;
(3)由表中数据可知:C≡O→C═O,需吸收1071kJ-803kJ=268kJ能量,N≡N→N═N,需吸收945kJ-418kJ=427kJ能量,
CO中第一个π键的键能比N2的第一个π键的键能小很多,CO的第一个π键容易断裂,说明CO比N2活泼.
故答案为:CO中第一个π键的键能比N2的第一个π键的键能小很多,CO的第一个π键容易断裂;
(4)由晶胞结构可知,Cu位于晶胞内部,则一个晶胞含有4个Cu,故答案为:4.
点评:本题考查较为综合,设计配位键、晶胞的计算等知识,题目难度中等,注意原子核外电子排布与物质性质的关系,当价层电子轨道处于全空、全充满、半充满时,较稳定.

练习册系列答案
相关题目

 ”表示该晶体中的一个原子,请在该立方体的顶点上用“
”表示该晶体中的一个原子,请在该立方体的顶点上用“ ”表示出与之紧邻的原子.
”表示出与之紧邻的原子.

 ,平面结构)属于
,平面结构)属于 (2013?菏泽二模)[化学-物质结构与性质]
(2013?菏泽二模)[化学-物质结构与性质]