摘要:11.解析:由①可知碱石灰吸收的是CO2或H2O或两者的混合物,由②可知.CuO被还原为Cu.还原剂为CO或H2或二者的混合物,由③可知.反应②生成了H2O.故原混合气体中一定有氢气,由反应④可知.反应②又生成了CO2.故原混合气体中一定有CO. 答案:混合气体中一定含有CO.H2.至少含有H2O.CO2中的一种.
网址:http://m.1010jiajiao.com/timu3_id_194112[举报]
已知:
在油田开采的石油中,通常溶有一种碳氢化合物,其分子的立体结构如下图所示(该图为键线式)
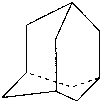
(1)由图可知其化学式为 .
(2)该笼状结构有 个六元碳环构成,其中有 个碳原子为三个环共有.
(3)该物质的一氯代物有 种.
(4)将0.1mol该物质在一定量O2中燃烧,两者恰好反应完全,生成的气体产物再通过碱石灰吸收,碱石灰增重40.8g,则消耗O2的物质的量为多少?
查看习题详情和答案>>

在油田开采的石油中,通常溶有一种碳氢化合物,其分子的立体结构如下图所示(该图为键线式)

(1)由图可知其化学式为
(2)该笼状结构有
(3)该物质的一氯代物有
(4)将0.1mol该物质在一定量O2中燃烧,两者恰好反应完全,生成的气体产物再通过碱石灰吸收,碱石灰增重40.8g,则消耗O2的物质的量为多少?
(8分)已知:

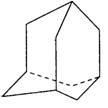
在油田开采的石油中,通常溶有一种碳氢化合物,其分子的立体结构如图所示(该图为键线式)
⑴由图可知其化学式为 。
⑵该笼状结构有 个六元碳环构成,其中有 个碳原子为三个环共有。
⑶该物质的一氯代物有 种。
⑷将0.1mol该物质在一定量O2中燃烧,两者恰好反应完全,生成的气体产物再通过碱石灰吸收,碱石灰增重40.8g,则消耗O2的物质的量为多少?
查看习题详情和答案>>(2013?重庆模拟)某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.
甲同学认为沉淀可能是CuCO3;
乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物(两者都不含结晶水).
Ⅰ.按照乙同学的观点,你认为其原理是
Ⅱ.将上述产生的蓝色沉淀洗涤、干燥后放入试管中加热,定性探究生成物的成分.
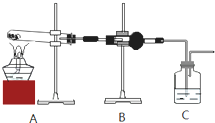
(1)B装置中试剂的化学式是
(2)能证明乙同学观点正确的实验现象是
Ⅲ.研究性学习小组的同学为了测定一包由CuCO3和Cu(OH)2组成的混合物中Cu(OH)2的质量分数,设计出下列装置进行实验.
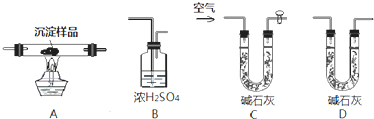
(1)各装置连接的顺序为
(2)实验开始和结束时都要通入过量的空气,结束时通入过量空气的作用是
(3)若沉淀样品的质量为m g,装置D质量增加了n g,则其中Cu(OH)2的质量分数为
%
%.
(4)利用上述装置测出的Cu(OH)2质量分数偏低,其原因是
查看习题详情和答案>>
甲同学认为沉淀可能是CuCO3;
乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物(两者都不含结晶水).
Ⅰ.按照乙同学的观点,你认为其原理是
Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
(用离子方程式表示).Ⅱ.将上述产生的蓝色沉淀洗涤、干燥后放入试管中加热,定性探究生成物的成分.

(1)B装置中试剂的化学式是
CuSO4
CuSO4
,C装置中试剂的名称是澄清石灰水
澄清石灰水
;(2)能证明乙同学观点正确的实验现象是
B中白色固体变为蓝色,C中澄清石灰水不变浑浊
B中白色固体变为蓝色,C中澄清石灰水不变浑浊
.Ⅲ.研究性学习小组的同学为了测定一包由CuCO3和Cu(OH)2组成的混合物中Cu(OH)2的质量分数,设计出下列装置进行实验.

(1)各装置连接的顺序为
CABD
CABD
;(2)实验开始和结束时都要通入过量的空气,结束时通入过量空气的作用是
可以将装置中滞留的水蒸气和二氧化碳赶出
可以将装置中滞留的水蒸气和二氧化碳赶出
;(3)若沉淀样品的质量为m g,装置D质量增加了n g,则其中Cu(OH)2的质量分数为
| 100(11m-31n) |
| 11m |
| 100(11m-31n) |
| 11m |
(4)利用上述装置测出的Cu(OH)2质量分数偏低,其原因是
空气中的水蒸气和二氧化碳被装置D中的碱石灰吸收
空气中的水蒸气和二氧化碳被装置D中的碱石灰吸收
.Ⅰ.燃烧法是测定有机物分子式的一种重要方法.标准状况下1.12L某气态烃在足量氧气中完全燃烧,若将产物通入足量澄清石灰水,得到白色沉淀20g;若用足量碱石灰吸收燃烧产物,增重13.3g.则丙的分子式为
Ⅱ.工业上可以用丙物质来生产乙物质,反应方程式可表示(已配平):丙
甲+乙.有机物乙的产量可以用来衡量一个国家的石油化工发展水平.
(1)写出乙的结构简式为
(2)由丙得到甲的过程在石油炼制中称为
(3)由甲和乙都可以制得CH3CH2Cl(一氯乙烷),写出这两个反应的化学方程式,注明反应类型.
甲:
乙:
查看习题详情和答案>>
C4H10
C4H10
,写出丙可能存在的结构简式并命名:CH3CH2CH2CH3正丁烷;CH3CH(CH3)CH3异丁烷
CH3CH2CH2CH3正丁烷;CH3CH(CH3)CH3异丁烷
;Ⅱ.工业上可以用丙物质来生产乙物质,反应方程式可表示(已配平):丙
| 500℃ |
(1)写出乙的结构简式为
CH2=CH2
CH2=CH2
,乙的名称为乙烯
乙烯
;(2)由丙得到甲的过程在石油炼制中称为
裂解
裂解
;(3)由甲和乙都可以制得CH3CH2Cl(一氯乙烷),写出这两个反应的化学方程式,注明反应类型.
甲:
CH3CH3+Cl2
CH3CH2Cl+HCl
| 光 |
CH3CH3+Cl2
CH3CH2Cl+HCl
,| 光 |
取代反应
取代反应
反应;乙:
CH2=CH2+HCl
CH3CH2Cl
| 一定条件 |
CH2=CH2+HCl
CH3CH2Cl
,| 一定条件 |
加成反应
加成反应
反应.蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁的实验步骤如图所示.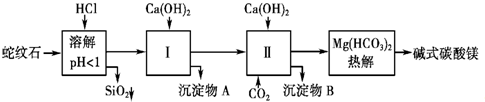
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见上表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是
(5)现设计一个实验,确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量
②高温分解
③
④
⑤MgO称量
(6)18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:
a=
查看习题详情和答案>>

(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是
Fe3+、Al3+
Fe3+、Al3+
.| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
Al(OH)3
Al(OH)3
溶解、Mg(OH)2
Mg(OH)2
沉淀.(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入
NaOH或Ca(OH)2
NaOH或Ca(OH)2
(填入物质的化学式),然后过滤、洗涤、灼烧
过滤、洗涤、灼烧
(依次填写实验操作名称).(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是
CaCO3或CO2
CaCO3或CO2
(填写物质化学式).(5)现设计一个实验,确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量
②高温分解
③
用浓硫酸吸收水蒸气
用浓硫酸吸收水蒸气
.④
称量碱石灰吸收CO2前后的质量
称量碱石灰吸收CO2前后的质量
.⑤MgO称量
(6)18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:
a=
3
3
,b=1
1
,c=3
3
.