网址:http://m.1010jiajiao.com/timu3_id_193954[举报]
(10分)工业上综合利用黄铜矿(CuFeS2)制备净水剂高铁酸钠(Na2FeO4)、铜及其化合物的工业流程如下图所示:
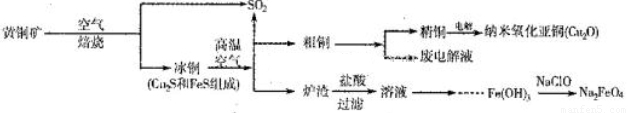
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
(2)利用炉渣(含Fe2O3、FeO、SiO2、Al2O3)制备高铁酸钠的方法为:
①用稀盐酸浸取炉渣,过滤;
②向滤液中加入足量H2O2溶液,再加入足量NaOH溶液,过滤,将沉淀洗涤、于燥得Fe(0H)3;
③Fe(OH)3与NaClO和NaOH反应,生成高铁酸钠。
a.写出制取高铁酸钠的化学方程式:______________________;
b.验证炉渣中含有FeO必要的化学试剂为________________________。
(3)制备纳米氧化亚铜(Cu2O)时用铜棒和石墨做电极,饱和食盐水做电解质,电解反应为2Cu+H2O Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
|
n(SO32-):n(HSO3-) |
91:9 |
1:1 |
1:91 |
|
pH(25℃) |
8.2 |
7.2 |
6.2 |
当吸收液呈中性时,溶液中离子浓度由大到小的顺序为是________________。
查看习题详情和答案>>
铜在自然界存在于多种矿石中,如黄铜矿(CuFeS2)、辉铜矿(Cu2S)、孔雀石(CuCO3·Cu(OH)2)等。
(1)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,由黄铜矿冶炼铜的反应为:8 CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16 SO2。
① 在反应产物中加入过量的盐酸溶解,其溶液中含有的阳离子为 。
② 上述冶炼过程产生大量的SO2。某实验小组欲探究二氧化硫的化学性质,设计如下实验,请完成实验报告。
| 序号 | 二氧化硫的性质 | 主要操作和现象 | 化学方程式 | |||||
| Ⅰ | 将二氧化硫通入装有品红溶液的试管中,品红由红色变为无色 | |||||||
| Ⅱ | 氧化性[来源:学科网] | |||||||
| Ⅲ | 将二氧化硫通入装有新制氯水的试管中,氯水由浅黄绿色色变为无色 | |||||||
| ||||||||
(2)孔雀石在一定条件F能发生分解反应,其产物有如下转化关系。E为相对分子质量为44且能和新制的氢氧化铜在加热下反应的化合物。

① D跟G反应的化学方程式为: :
② B和F反应的化学方程式为: 。
查看习题详情和答案>>铜在自然界存在于多种矿石中,如黄铜矿(CuFeS2)、辉铜矿(Cu2S)、孔雀石(CuCO3·Cu(OH)2)等。
(1)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,由黄铜矿冶炼铜的反应为:8 CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2
① 在反应产物中加入过量的盐酸溶解,其溶液中含有的阳离子为 。
② 上述冶炼过程产生大量的SO2。某实验小组欲探究二氧化硫的化学性质,设计如下实验,请完成实验报告
| 序号 |
| 二氧化硫的性质 |
| 主要操作和现象 | 化学方程式 | |||
| Ⅰ |
|
|
| 将二氧化硫通入装有品红溶液的试管中,品红由红色变为无色 |
| |||
| Ⅱ |
| 氧化性 |
|
|
| |||
| Ⅲ |
|
|
| 将二氧化硫通入装有新制氯水的试管中,氯水由浅黄绿色色变为无色 |
| |||
|
|
|
|
|
| ||||
(2)孔雀石在一定条件F能发生分解反应,其产物有如下转化关系。E为相对分子质量为44且能和新制的氢氧化铜在加热下反应的化合物

① D跟G反应的化学方程式为: :
② B和F反应的化学方程式为: .
查看习题详情和答案>>
铜在自然界存在于多种矿石中,如黄铜矿(CuFeS2)、辉铜矿(Cu2S)、孔雀石(CuCO3·Cu(OH)2)等。
(1)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,由黄铜矿冶炼铜的反应为:8 CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16 SO2
① 在反应产物中加入过量的盐酸溶解,其溶液中含有的阳离子为 。
② 上述冶炼过程产生大量的SO2。某实验小组欲探究二氧化硫的化学性质,设计如下实验,请完成实验报告
|
序号 |
|
二氧化硫的性质 |
|
主要操作和现象 |
化学方程式 |
|||
|
Ⅰ |
|
|
|
将二氧化硫通入装有品红溶液的试管中,品红由红色变为无色 |
|
|||
|
Ⅱ |
|
氧化性 |
|
|
|
|||
|
Ⅲ |
|
|
|
将二氧化硫通入装有新制氯水的试管中,氯水由浅黄绿色色变为无色 |
|
|||
|
|
|
|
|
|
||||
(2)孔雀石在一定条件F能发生分解反应,其产物有如下转化关系。E为相对分子质量为44且能和新制的氢氧化铜在加热下反应的化合物

① D跟G反应的化学方程式为: :
② B和F反应的化学方程式为: .
查看习题详情和答案>>
(1)冶炼铜的反应为8CuFeS2+21O2
| ||
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
(2)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主成分是碱酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 例在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |
通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应的催化过程.
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3.方法为
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得.
据以上信息回答下列问题:
a.除去AI2O3的离子方程式是
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为