摘要:熟练掌握各基本实验操作技能(制气分型.型.集气有排水法.排空气法.干燥.净化-) 2.培养审准实验目的.审定全系统步骤先后顺序合理.以达目的的能力 [要点讲解]
网址:http://m.1010jiajiao.com/timu3_id_193919[举报]
(2011?宜宾模拟)CoCl2?6H2O是一种饲料营养强化剂.以含钴(Co)废料(含少量Fe、Al等杂质)制取CoCl2?6H2O的一种新工艺,流程如图:

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2?6H2o熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)在上述工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为
(2)加入碳酸钠调节pH至a,a的范围是
(3)操作I包含3个基本实验操作,它们是
(4)制得的CoCl2?6H2O需减压烘干的原因是
(5)为测定产品中CoCl2?6H2O的含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2?6H2O的质量分数大于100%,其原因可能是
(6)在实验室中,为了从上述产品中获得纯净的CoCl2?6H2O,采用的方法是
查看习题详情和答案>>

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2?6H2o熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.0 | 9.7 | 9.2 | 5.2 |
(1)在上述工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为
减少有毒气体的排放,防止大气污染;防止产品中混有硝酸盐
减少有毒气体的排放,防止大气污染;防止产品中混有硝酸盐
.(2)加入碳酸钠调节pH至a,a的范围是
5.2≤a≤7.6
5.2≤a≤7.6
.(3)操作I包含3个基本实验操作,它们是
蒸发浓缩、冷却结晶
蒸发浓缩、冷却结晶
和过滤.(4)制得的CoCl2?6H2O需减压烘干的原因是
降低烘干温度,防止产品分解
降低烘干温度,防止产品分解
.(5)为测定产品中CoCl2?6H2O的含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2?6H2O的质量分数大于100%,其原因可能是
样品中含有氯化钠杂质;烘干时失去了部分结晶水
样品中含有氯化钠杂质;烘干时失去了部分结晶水
.(6)在实验室中,为了从上述产品中获得纯净的CoCl2?6H2O,采用的方法是
将产品溶于乙醚,过滤后再蒸馏
将产品溶于乙醚,过滤后再蒸馏
.下面A~E是中学化学实验中常见的几种实验装置,试回答下列问题:
(1)请为进行下列实验挑选合适的装置(填序号字母)
①量气装置是
③蒸发装置是
⑤消石灰与氯化铵共热制NH3选用
(2)其中常用于物质的分离和提纯的装置是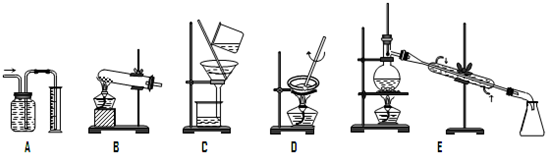
查看习题详情和答案>>
(1)请为进行下列实验挑选合适的装置(填序号字母)
①量气装置是
A
A
②过滤装置是C
C
③蒸发装置是
D
D
④蒸馏装置是E
E
⑤消石灰与氯化铵共热制NH3选用
B
B
⑥I2的CCl4溶液中提取I2选用E
E
(2)其中常用于物质的分离和提纯的装置是
CDE
CDE
(填序号),请另写出一种要用到分液漏斗进行分离和提纯的基本实验操作的名称萃取、分液
萃取、分液
.
氯化铜晶体(CuCl2?xH2O)是重要的化工原料,可用作催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
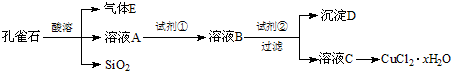
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
(1)若溶液A含有的金属离子有Cu2+、Fe2+、Fe3+,则试剂①选用
A.Cu B.Cl2 C.NH3?H2O D.NaOH
(2)加入试剂②的目的是调节pH至a,a的范围是
(3)为了测定制得的氯化铜晶体(CuCl2?xH2O)中x值,有同学设计了如下两种实验方案:
①称取一定质量的晶体加热使其失去结晶水,称量所得无水CuCl2的质量.该方案存在的问题是
②称取a g晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀至质量不再减轻为止,称量所得固体的质量为b g.则x=
(用含a、b的代数式表示).
查看习题详情和答案>>

已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 5.4 | 8.1 |
| 沉淀完全的pH | 3.7 | 6.9 | 9.6 |
B
B
(填字母).A.Cu B.Cl2 C.NH3?H2O D.NaOH
(2)加入试剂②的目的是调节pH至a,a的范围是
3.7~5.4
3.7~5.4
.由溶液C获得CuCl2?xH2O,包含4个基本实验操作,这4个基本实验操作依次是蒸发浓缩
蒸发浓缩
、冷却结晶
冷却结晶
过滤和无水乙醇洗涤等操作,使用无水乙醇代替水进行洗涤的主要原因是防止CuCl2?xH2O晶体溶解损失
防止CuCl2?xH2O晶体溶解损失
.(3)为了测定制得的氯化铜晶体(CuCl2?xH2O)中x值,有同学设计了如下两种实验方案:
①称取一定质量的晶体加热使其失去结晶水,称量所得无水CuCl2的质量.该方案存在的问题是
CuCl2?xH2O晶体加热时会发生水解
CuCl2?xH2O晶体加热时会发生水解
.②称取a g晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀至质量不再减轻为止,称量所得固体的质量为b g.则x=
| 80a-135b |
| 18b |
| 80a-135b |
| 18b |
(2011?连云港模拟)CoCl2?6H2O是一种饲料营养强化剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2?6H2O的一种新工艺流程如图:
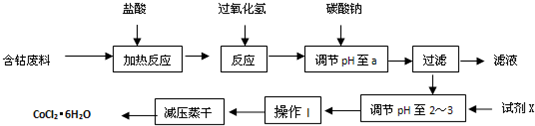
已知:①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2?6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为
(2)加入过氧化氢反应的离子方程式是
(3)加入碳酸钠调节pH至a,a的范围是
(4)操作Ⅰ包含3个基本实验操作,它们是
(5)制得的CoCl2?6H2O需减压烘干的原因是
(6)在实验室中,为了从上述产品中获得纯净的CoCl2?6H2O,采用的方法是
查看习题详情和答案>>

已知:①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2?6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 | 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为
减少有毒气体的排放,防止大气污染,防止产品中混有硝酸盐
减少有毒气体的排放,防止大气污染,防止产品中混有硝酸盐
.(2)加入过氧化氢反应的离子方程式是
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
(3)加入碳酸钠调节pH至a,a的范围是
5.2~7.6
5.2~7.6
,pH调至a后过滤,再用试剂X将滤液的pH调节至2~3,所用的试剂X为盐酸
盐酸
.(4)操作Ⅰ包含3个基本实验操作,它们是
蒸发浓缩
蒸发浓缩
、冷却结晶
冷却结晶
和过滤.(5)制得的CoCl2?6H2O需减压烘干的原因是
降低烘干温度,防止产品分解
降低烘干温度,防止产品分解
.(6)在实验室中,为了从上述产品中获得纯净的CoCl2?6H2O,采用的方法是
将产品溶于乙醚过滤后,再蒸馏
将产品溶于乙醚过滤后,再蒸馏
.