摘要:电离及电离方程式: [课后学案] 夯实基础
网址:http://m.1010jiajiao.com/timu3_id_193235[举报]
 Ⅰ.某溶液中仅含如表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol.
Ⅰ.某溶液中仅含如表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol.| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是
(2)原溶液中含有的阳离子是
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为
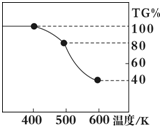
Ⅱ.草酸亚铁晶体(FeC2O4?2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4).草酸亚铁晶体在氩气气氛中进行热重分析,结果如图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题:
(5)草酸亚铁晶体中碳元素的化合价为:
(6)A→B发生反应的化学方程式为
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为:
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
(1)丙烷脱氢可得丙烯.
已知:C3H8(g)=CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ?mol-1
CH3CH=CH2(g)=CH4(g)+HC≡CH(g )△H2=+32.4kJ?mol-1
则相同条件下,丙烷脱氢得丙烯的热化学方程式为 .
(2)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol?L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3的第一级电离的平衡常数K1= .(已知10-5.60=2.5×10-6)
(3)有关①100ml 0.1mol/L NaHCO3、②100ml 0.1mol/L Na2CO3两种溶液:溶液中水电离出的H+个数:① ②(填”>”、”<”或”=”)溶液中阴离子的物质的量浓度之和:① ②(填”>”、”<”或”=”)常温下,①溶液中的pH大于7,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明).
查看习题详情和答案>>
(1)丙烷脱氢可得丙烯.
已知:C3H8(g)=CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ?mol-1
CH3CH=CH2(g)=CH4(g)+HC≡CH(g )△H2=+32.4kJ?mol-1
则相同条件下,丙烷脱氢得丙烯的热化学方程式为
(2)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol?L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3的第一级电离的平衡常数K1=
(3)有关①100ml 0.1mol/L NaHCO3、②100ml 0.1mol/L Na2CO3两种溶液:溶液中水电离出的H+个数:①
为减小和消除过量CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.最近有科学家提出“绿色自由”构想:把CO2经化学反应而富集,使之变为可再生燃料,如甲醇、甲醚等.
(1)已知甲醚的燃烧热为A kJ/mol,H2的燃烧热为B kJ/mol.在合成塔中,CO2与H2在一定条件下生成液态甲醚和液态水,试写出合成塔中发生反应的热化学方程式是 .
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,用熔融金属氧化物MO作电解质.该电池负极发生的电极反应是 ;放电时,O2-移向电池的 (填“正”或“负”)极.用这样的电池电解足量的硫酸铜溶液,一段时间后,(不考虑任何的损耗)消耗的O2与生成的H+物质的量之比 .
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol?L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的平衡常数K= .(已知:10-5.6=2.5×10-6)(结果保留2位有效数字)
(4)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”).
查看习题详情和答案>>
(1)已知甲醚的燃烧热为A kJ/mol,H2的燃烧热为B kJ/mol.在合成塔中,CO2与H2在一定条件下生成液态甲醚和液态水,试写出合成塔中发生反应的热化学方程式是
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,用熔融金属氧化物MO作电解质.该电池负极发生的电极反应是
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol?L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的平衡常数K=
(4)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)
(2013?上饶一模)某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L
甲同学欲探究废水的组成,进行了如下实验
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变
Ⅳ. 向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式
(4)甲同学最终确定原溶液中所含阳离子是
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为
(6)工业废水中常含有不同类型的污染物,可采用不同的方法处理.以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是
查看习题详情和答案>>
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl-CO32- NO3- SO42- SiO32- |
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变
Ⅳ. 向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是
K+、Fe3+
K+、Fe3+
(写离子符号).(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
.(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
(4)甲同学最终确定原溶液中所含阳离子是
Fe2+、Cu2+
Fe2+、Cu2+
,阴离子是Cl-、NO3-、SO42-
Cl-、NO3-、SO42-
.(写离子符号)(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为
1.6
1.6
g.(6)工业废水中常含有不同类型的污染物,可采用不同的方法处理.以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是
D
D
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 碱性的废水 | 用CO2来中和 | 化学法 |
某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L.
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为
(4)甲同学最终确定原溶液中所含阳离子是
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为
查看习题详情和答案>>
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl-CO32- NO3- SO42- SiO32- |
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是
K+、Fe3+
K+、Fe3+
(写离子符号).(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是
3Fe2++NO3-+4H+═3Fe3++NO+2H2O
3Fe2++NO3-+4H+═3Fe3++NO+2H2O
.(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
.(4)甲同学最终确定原溶液中所含阳离子是
Fe2+、Cu2+
Fe2+、Cu2+
,阴离子是Cl-、NO3-、SO42-
Cl-、NO3-、SO42-
(写离子符号).(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为
1.6g
1.6g
g.