摘要:(三)卤素单质的物理性质 颜色: 状态: 密度: 熔沸点: 在水中的溶解性:
网址:http://m.1010jiajiao.com/timu3_id_193149[举报]
下列叙述正确的是( )
| A、碱金属单质在空气中燃烧的生成物都是过氧化物 | B、少量的碱金属单质都能保存在煤油中 | C、HF、HCl、HBr、HI的稳定性、还原性从上到下依次减弱 | D、随着原子序数的递增,卤素单质的颜色由浅到深,熔沸点逐渐升高 |
 (2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.(1)在光照条件下.氯气和氢气反应过程如下:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl …
反应②中形成的化合物的电子式为


非极性
非极性
键(填“极性”或“非极性”).(2)在短周期主族元素中,氯元素及与其相邻元素的原予半径从大到小的顺序是
S>Cl>F
S>Cl>F
.(用元素符号表示).与氯元素同周期且金属性最强的元素位于周期表的第
三
三
周期IA
IA
族.(3)卤索单质及化合物在许多性质上都存在着递变规律.下列有关说法正确的是
a
a
.a.卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深
b?卤化氢的键长按H-F、H-Cl、H-Br、H-I的顺序依次减小
c?卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d?卤索单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
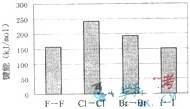
(4)卤素单质的键能大小如图.由图推断:
①非金属性强的卤素,其单质分子的化学键
不一定容易
不一定容易
断裂(填“容易”或“不容易”或“不一定容易”).②卤素单质键能大小与键长的关系为:
除F2外.键长增大,键能减小
除F2外.键长增大,键能减小
.下列说法不正确的是( )
| A、阳离子的氧化性:Li+<Na+<K+ | B、卤素单质的颜色随核电荷数的增大而加深 | C、碱金属单质的熔沸点随核电荷数的增加而降低 | D、卤素单质从其卤化物中被置换出来的可能性随核电荷数的增加而增加 |
![]() 海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
![]() (1)在光照条件下,氯气和氢气反应过程如下:
(1)在光照条件下,氯气和氢气反应过程如下:
![]() ①
①![]() ②
②![]() ③
③![]() ……
……
![]() 反应②中形成的化合物的电子式为 ;反应③中被破坏的化学键属
反应②中形成的化合物的电子式为 ;反应③中被破坏的化学键属![]() 键(填“极性”或“非极性”)。
键(填“极性”或“非极性”)。
![]() (2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是
![]() (用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期 族。
(用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期 族。
![]() (3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
![]() a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
![]() b.卤化氢的键长按H—F、H—C1、H—Br、H—I的顺序依次减小
b.卤化氢的键长按H—F、H—C1、H—Br、H—I的顺序依次减小
![]() c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
![]() d.卤素单质与氢气化合按
d.卤素单质与氢气化合按![]() 、
、![]() 、
、![]() 、
、![]() 的顺序由难变易
的顺序由难变易
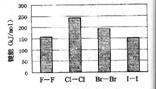
![]() (4)卤素单质的键能大小如右图。由图推断:
(4)卤素单质的键能大小如右图。由图推断:
![]() ①非金属性强的卤素,其单质分子的化学键
①非金属性强的卤素,其单质分子的化学键 ![]() 断裂(填“容易”或“不容易”或“不一定容易”)。
断裂(填“容易”或“不容易”或“不一定容易”)。
![]() ②卤素单质键能大小与键长的关系为:
②卤素单质键能大小与键长的关系为:![]()