网址:http://m.1010jiajiao.com/timu3_id_193097[举报]
(12分)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | |
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断BeCl2中的化学键类型是 。
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性之间的关系 ;简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系 。
(3)某化合物分子中含有S—N键,你认为该共用电子对偏向于 原子(填元素符号)。
(4)写出O原子的电子排布图
(5)Cl元素的最高正价为 ,其最高价氧化物的水化物的化学式为 。
(6)若要鉴定某化合物中是否含有S元素,需用 的方法;若要确定C2H6O的结构,需用 的方法,分子式为C2H6O的两种不同的结构简式分别为 , ,这两种结构互为 。 查看习题详情和答案>>
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | |
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断BeCl2中的化学键类型是 。
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性之间的关系 ;简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系 。
(3)某化合物分子中含有S—N键,你认为该共用电子对偏向于 原子(填元素符号)。
(4)写出O原子的电子排布图
(5)Cl元素的最高正价为 ,其最高价氧化物的水化物的化学式为 。
(6)若要鉴定某化合物中是否含有S元素,需用 的方法;若要确定C2H6O的结构,需用 的方法,分子式为C2H6O的两种不同的结构简式分别为 , ,这两种结构互为 。
硅——无机非金属材料的主角.未来的交通工具将采用新一代无机非金属材料制成的无水冷发动机.这类材料中研究得较多的是化合物G.
(1)化合物G的相对分子质量为140,G为两种元素组成的化合物,其中硅元素的质量分数为60%,另一种元素为空气中含量最高的元素Y.
①化合物G的化学式为________,
②G可以由四氯化硅与NH3在反应而生成,同时产生HCl气体.写出反应方程式________
(2)粉末状G在高温下可与水发生反应,写出其反应方程式________;
(3)水泥是重要的无机非金属材料之一,普通水泥在固化过程中自由水分子减少并形成碱性溶液.根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间.此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是________
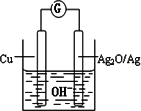
A.工业上以黏土、石灰石和石英为主要原料来制造普通水泥
B.负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O
C.测量原理示意图中,电流方向从Cu→Ag2O
D.电池工作时,OH-向正极移动
(4)已知粗硅提纯,总反应式可用表示为:
SiCl4(g)+2H2(g) Si(s)+4HCl(g),ΔH=+236 kJ·mol-1下表是部分化学键的键能数据:
则上表中x=________.
| 元素 | 相关信息 |
| W | 单质为密度最小的气体 |
| X | 元素最高正价与最低负价之和为0 |
| Y | 工业上通过分离液态空气获得其单质,该单质的某种同素异形体是保护地球地表环境的重要屏障 |
| Z | 存在质量数为23,中子数为12的核素 |
| T | 金属单质为红色,导电性好,是人体不可缺少的徽量元素,焰色反应时火焰为绿色 |
(1)元素Y在元素周期表中的位置是
(2)化合物甲是一种强氧化剂,由元素Y和Z组成,写出甲的化学式:
(3)化合物乙由元素W和X组成,乙是同时含极性共价键和非极性共价键的相对分子质量最小的分子.在25℃、101kpa下,已知2g的气体乙在Y2气体中完全燃烧后恢复至原状态,放热QkJ,该燃烧反应的热化学方程式是
(4)化合物丙仅由W、X、Y、Z、T中的四种元素组成,四种元素的质量比为1:6:40:64,化合物丙中含有两种阴离子,写出加热丙的化学方程式
下表给出了五种元素的相关信息,其中w、X、Y、Z为短周期元素,原子序数依次递增。
|
元素 |
相关信息 |
|
W |
单质为密度最小的气体 |
|
X |
元素最高正价与最低负价之和为0 |
|
Y |
工业上通过分离液态空气获得其单质,该单质的某种同素异形体是保护地球地表环境的重要屏障 |
|
Z |
存在质量数为23,中子数为12的核素 |
|
T |
金属单质为红色,导电性好,是人体不可缺少的徽量元素,焰色反应时火焰为绿色 |
根据上述信息填空:
(1)元素Y在元素周期表中的位置是 。XY2由固态变为气态所需克服的微粒间作用力是 。
(2)化合物甲是一种强氧化剂,由元素Y和Z组成,写出甲的化学式: ,
(3)化合物乙由元素W和X组成,乙是同时含极性共价键和非极性共价键的相对分子质量最小的分子。在25℃、101kpa下,已知2g的气体乙在Y2气体中完全燃烧后恢复至原状态,放热QkJ,该燃烧反应的热化学方程式是 。
(4)化合物丙仅由W、X、Y、Z、T中的四种元素组成,四种元素的质量比为1:6:40:64,化合物丙中含有两种阴离子,写出燃烧丙的化学方程式 。
查看习题详情和答案>>