摘要:CH4(g)+2O2(g)==CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
网址:http://m.1010jiajiao.com/timu3_id_193070[举报]
已知CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1。当一定量的CH4(g)完全燃烧生成CO2(g)和2H2O(l)所放出的热量为74 kJ,所需空气在标准状况下的体积约为(空气中N2与O2的体积比为4∶1计算)( )
CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1。当一定量的CH4(g)完全燃烧生成CO2(g)和2H2O(l)所放出的热量为74 kJ,所需空气在标准状况下的体积约为(空气中N2与O2的体积比为4∶1计算)( )
A.
已知:CH4(g)+2O2(g)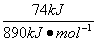 CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1。当一定量的CH4(g)完全燃烧生成CO2(g)和H2O(l)所放出的热量为74 kJ,所需空气在标准状况下的体积约为(空气中N2与O2的体积比为4∶1计算)
CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1。当一定量的CH4(g)完全燃烧生成CO2(g)和H2O(l)所放出的热量为74 kJ,所需空气在标准状况下的体积约为(空气中N2与O2的体积比为4∶1计算)
A.
已知CH4(g)+2O2(g) CO2(g)+2H2O(l);ΔH=-890 kJ·mol-1,现有CH4和CO的混合气体共0.75 mol ,完全燃烧后,生成二氧化碳气体和18 g液态水,并放出515 kJ热量,则CO燃烧的热化学方程式为_________________,CO的燃烧热为________。
查看习题详情和答案>>
CO2(g)+2H2O(l);ΔH=-890 kJ·mol-1,现有CH4和CO的混合气体共0.75 mol ,完全燃烧后,生成二氧化碳气体和18 g液态水,并放出515 kJ热量,则CO燃烧的热化学方程式为_________________,CO的燃烧热为________。
查看习题详情和答案>>