题目内容
(1)将不同量的CO(g)和H2O(g)分别通入体积2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
①实验1中以v(CO2)表示的平均反应速率为 (第二位小数)。
②该反应为 (填“吸热”或“放热”)反应。
③求实验2的平常常数K,要求写出计算过程,结果取二位小数。
(2)已知在常温常压下:

写出甲醇不完全燃烧生成CO和液态水的热化学方程式 。
(3)甲醇和氧气完全燃烧的反应可以设计为燃料电池,装置如图,该电池通过K2CO3溶液吸收反应生的CO2。则负极的电极反应为 。

(4)CaCO3的KSP=2.8×10¯9。将等体积CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10¯4mol/L,则生成沉淀所需该CaCl2溶液的最小浓度为 。
 CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1中以v(CO2)表示的平均反应速率为 (第二位小数)。
②该反应为 (填“吸热”或“放热”)反应。
③求实验2的平常常数K,要求写出计算过程,结果取二位小数。
(2)已知在常温常压下:

写出甲醇不完全燃烧生成CO和液态水的热化学方程式 。
(3)甲醇和氧气完全燃烧的反应可以设计为燃料电池,装置如图,该电池通过K2CO3溶液吸收反应生的CO2。则负极的电极反应为 。

(4)CaCO3的KSP=2.8×10¯9。将等体积CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10¯4mol/L,则生成沉淀所需该CaCl2溶液的最小浓度为 。
(16分)
(1) ①0.13mol/(L·min) (3分) ②放热 (2分)
③ CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 1 0.5 0 0
变化浓度(mol/L) 0.2 0.2 0.2 0.2
平衡浓度(mol/L) 0.8 0.3 0.2 0.2
所以,K=(0.2×0.2)/(0.8×0.3)= 0.17 (4分,三行式2分,表达式1分,答案1分)
(2)CH3OH(l) + O2(g) =" CO(g)" + 2H2O(l) (2分)ΔH=-442.8 kJ∕mol (1分)
(3)CH3OH - 6e- + 7CO32-+ 2H2O= 8HCO3- (2分)
(4)5.6×10-5mo1/L (2分)
(1) ①0.13mol/(L·min) (3分) ②放热 (2分)
③ CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)起始浓度(mol/L) 1 0.5 0 0
变化浓度(mol/L) 0.2 0.2 0.2 0.2
平衡浓度(mol/L) 0.8 0.3 0.2 0.2
所以,K=(0.2×0.2)/(0.8×0.3)= 0.17 (4分,三行式2分,表达式1分,答案1分)
(2)CH3OH(l) + O2(g) =" CO(g)" + 2H2O(l) (2分)ΔH=-442.8 kJ∕mol (1分)
(3)CH3OH - 6e- + 7CO32-+ 2H2O= 8HCO3- (2分)
(4)5.6×10-5mo1/L (2分)
试题分析:(1)①由于v=△c/△t=△n/(V?△t),生成物的起始量为0,则可先求v(H2)=1.6mol÷2L÷6min=0.4/3mol/(L?min),根据化学方程式中系数之比等于速率之比,则v(CO2)= v(H2)= 0.4/3mol/(L?min)≈0.13mol/(L?min);②③根据表中数据,实验1中:
CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)起始浓度(mol/L) 2 1 0 0
变化浓度(mol/L) 0.8 0.8 0.8 0.8
平衡浓度(mol/L) 1.2 0.2 0.8 0.8
所以650℃时该反应的K=(0.8×0.8)/(1.2×0.2)= 8/3≈2.7
实验2中:
CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)起始浓度(mol/L) 1 0.5 0 0
变化浓度(mol/L) 0.2 0.2 0.2 0.2
平衡浓度(mol/L) 0.8 0.3 0.2 0.2
所以900℃时该反应的K=(0.2×0.2)/(0.8×0.3)= 0.17
2.7>0.17,说明升高温度时K减小,前者导致平衡向吸热反应方向移动,后者说明平衡向逆反应方向移动,则逆反应是吸热反应,因此推断正反应是放热反应;(2)甲醇不完全燃烧生成一氧化碳,为了约去二氧化碳,观察已知热化学方程式可知,(①—②)/2可得:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8 kJ∕mol;(3)依题意可知,负极的主要反应物和产物是甲醇和碳酸氢根离子,则CH3OH→HCO3-;甲醇中碳为—2价,则碳元素化合价升高总数为6,根据电子守恒可得:CH3OH—6e-→HCO3-;根据电荷守恒,用CO32-使左右电荷守恒,则CH3OH - 6e- + 7CO32-→8HCO3-;根据氢、氧原子个数守恒,则负极反应式为CH3OH - 6e- + 7CO32-+ 2H2O= 8HCO3-;(4)设所需氯化钙溶液的最小浓度为xmol/L,根据稀释定律可知,等体积混合后氯化钙的浓度变为x/2mol/L,而碳酸钠溶液的浓度变为2×10¯4mol/L /2=10¯4mol/L,则c(Ca2+)= x/2mol/L,c(CO32-)= 10¯4mol/L,由于CaCO3(s)
 Ca2++CO32-,则Ksp(CaCO3)=c(Ca2+)?c(CO32-),所以x/2×10¯4=2.8×10¯9,则x=5.6×10-5。
Ca2++CO32-,则Ksp(CaCO3)=c(Ca2+)?c(CO32-),所以x/2×10¯4=2.8×10¯9,则x=5.6×10-5。
练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目

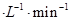
 ?2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( )
?2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( ) 2HI
2HI 2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率υ为( )
2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率υ为( ) 2SO3的化学反应速率,其中表示该反应进行最快的是( )
2SO3的化学反应速率,其中表示该反应进行最快的是( )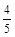 υ(NH3) =υ(O2)
υ(NH3) =υ(O2)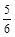 υ(O2) =υ(H2O)
υ(O2) =υ(H2O)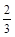 υ(NH3) =υ(H2O)
υ(NH3) =υ(H2O)