摘要:在容积不变密闭容器中.对于合成氨反应是否达到平衡的标志是 ①V(N2)∶V(H2)= 1∶3 ②V(N2)∶V(NH3)= 1∶2 ③ V(NH3)= 2 V(N2) ④V(NH3)分解= V(NH3)合成 ⑤ C(NH3)= 2 C(N2) ⑥压强不变 ⑦每消耗 n mol N2的同时生成 2n mol NH3 ⑧密度不变 ⑨混合气体中氮气的体积百分含量不变 [小结]判断化学反应达到平衡的标志: 两大特征:①v②各组分浓度保持不变 总之.若反应过程中变化的量保持不变.则反应达到平衡状态 反应 mA+qD(g) 状态 体系中各成分的量 ①各物质的量或量的分数一定 ②总体积.总压力.总物质的量一定 v的关系 ①v ②各物质的速率之比等于化学计量数之比 压强 ①若m+n≠p+q时.总压力一定 ②m+n=p+q时.总压力一定 混合气体的平均分子量 ①当一定时.且m+n≠p+q时 ②当一定时.且m+n=p+q时 温度 体系的温度不变时 气体的密度 密度不变时 颜色 反应体系内有色物质的颜色稳定不变 化学键的断裂与化学键的形成 同种物质化学键的断裂与化学键的形成的 物质的量相等 [概括·整合]
网址:http://m.1010jiajiao.com/timu3_id_192994[举报]
在2L密闭容器中反应2NO2(g)

2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题:
(1)对比实验Ⅰ、Ⅱ和Ⅲ,得出的下列结论中正确的是______.(填字母)
A. 实验Ⅱ和实验I相比,可能隐含的反应条件是:反应容器的体积缩小了
B.实验Ⅱ和实验I相比,可能隐含的反应条件是:使用效率更高的催化剂
C.实验I条件下该反应的平衡常数大于实验Ⅲ条件下该反应的平衡常数
D.对比实验Ⅰ和Ⅲ可知,该反应是吸热反应
(2)若实验Ⅰ中NO2的起始浓度改为1.2mol?L-1,其它条件不变,则达到平衡时所需用的时间______40min(填“大于”、“等于”或“小于”),NO2的转化率将______(填“增大”、“减小”或“不变”).
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入2mol由物质的量之比为1:1组成的NO2与NO混合气体(保持温度不变),则平衡将______(填“向左”、“向右”、“不”)移动,新平衡状态时NO2的物质的量浓度为______ mol?L-1.
(4)若将实验Ⅲ所得的平衡混和气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的氧气______L.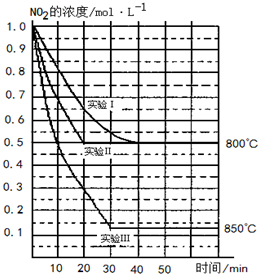
查看习题详情和答案>>

2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题:
(1)对比实验Ⅰ、Ⅱ和Ⅲ,得出的下列结论中正确的是______.(填字母)
A. 实验Ⅱ和实验I相比,可能隐含的反应条件是:反应容器的体积缩小了
B.实验Ⅱ和实验I相比,可能隐含的反应条件是:使用效率更高的催化剂
C.实验I条件下该反应的平衡常数大于实验Ⅲ条件下该反应的平衡常数
D.对比实验Ⅰ和Ⅲ可知,该反应是吸热反应
(2)若实验Ⅰ中NO2的起始浓度改为1.2mol?L-1,其它条件不变,则达到平衡时所需用的时间______40min(填“大于”、“等于”或“小于”),NO2的转化率将______(填“增大”、“减小”或“不变”).
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入2mol由物质的量之比为1:1组成的NO2与NO混合气体(保持温度不变),则平衡将______(填“向左”、“向右”、“不”)移动,新平衡状态时NO2的物质的量浓度为______ mol?L-1.
(4)若将实验Ⅲ所得的平衡混和气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的氧气______L.

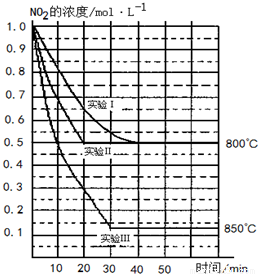
在2L密闭容器中反应2NO2(g)  2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度随时间(min)的变化如图所示.请回答下列问题:
2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度随时间(min)的变化如图所示.请回答下列问题:
(1)对比实验Ⅰ、Ⅱ和Ⅲ,得出的下列结论中正确的是______.(填字母)
A. 实验Ⅱ和实验I相比,可能隐含的反应条件是:反应容器的体积缩小了
B.实验Ⅱ和实验I相比,可能隐含的反应条件是:使用效率更高的催化剂
C.实验I条件下该反应的平衡常数大于实验Ⅲ条件下该反应的平衡常数
D.对比实验Ⅰ和Ⅲ可知,该反应是吸热反应
(2)若实验Ⅰ中NO2的起始浓度改为1.2mol?L-1,其它条件不变,则达到平衡时所需用的时间______40min(填“大于”、“等于”或“小于”),NO2的转化率将______(填“增大”、“减小”或“不变”).
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入2mol由物质的量之比为1:1组成的NO2与NO混合气体(保持温度不变),则平衡将______(填“向左”、“向右”、“不”)移动,新平衡状态时NO2的物质的量浓度为______ mol?L-1.
(4)若将实验Ⅲ所得的平衡混和气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的氧气______L.
 查看习题详情和答案>>
查看习题详情和答案>>
 2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度随时间(min)的变化如图所示.请回答下列问题:
2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度随时间(min)的变化如图所示.请回答下列问题:(1)对比实验Ⅰ、Ⅱ和Ⅲ,得出的下列结论中正确的是______.(填字母)
A. 实验Ⅱ和实验I相比,可能隐含的反应条件是:反应容器的体积缩小了
B.实验Ⅱ和实验I相比,可能隐含的反应条件是:使用效率更高的催化剂
C.实验I条件下该反应的平衡常数大于实验Ⅲ条件下该反应的平衡常数
D.对比实验Ⅰ和Ⅲ可知,该反应是吸热反应
(2)若实验Ⅰ中NO2的起始浓度改为1.2mol?L-1,其它条件不变,则达到平衡时所需用的时间______40min(填“大于”、“等于”或“小于”),NO2的转化率将______(填“增大”、“减小”或“不变”).
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入2mol由物质的量之比为1:1组成的NO2与NO混合气体(保持温度不变),则平衡将______(填“向左”、“向右”、“不”)移动,新平衡状态时NO2的物质的量浓度为______ mol?L-1.
(4)若将实验Ⅲ所得的平衡混和气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的氧气______L.
 查看习题详情和答案>>
查看习题详情和答案>>
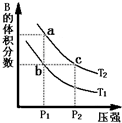 对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.
对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.(1)根据曲线图,分析下列说法正确的是
BC
BC
(填字母).A.a、c两点的反应速率:a>c
B.由状态b到状态a,可以通过加热的方法
C.b、c两点A气体的转化率相等
(2)上述反应在密闭容器(定容)中进行,达到平衡状态的标志是
BE
BE
(填字母).A.单位时间内生成n mol A的同时分解2n molB
B.两种气体的体积分数不再改变
C.v正(A)=2v逆(B)
D.混合气体的密度不再发生变化
E.混合气体的压强不再发生变化
(3)若上述反应达平衡时,B气体的平衡浓度为0.1mol?L-1,通过减小体积来增大体系的压强(温度保持不变),重新达平衡后,B气体的平衡浓度
>
>
0.1mol?L-1(填“>”、“<”或“=”).(4)在100℃时,将0.40mol的B气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(B)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(A)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
0.000875mol/(L?s)
0.000875mol/(L?s)
;②上表中n3
=
=
n4(填“>”、“<”或“=”),反应A(g)?2B(g)在100℃时的平衡常数K的值为0.36
0.36
,升高温度后,反应2B(g)?A(g)的平衡常数K的值减小
减小
(填“增大”、“减小”或“不变”);③若在相同情况下最初向该容器中充入的是A气体,要达到上述同样的平衡状态,A气体的起始浓度为
0.1
0.1
mol?L-1. 合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.Ⅰ.在体积为5L的恒温、恒容密闭容器甲中,起始时投入2mol N2、3mol H2,经过10s达到平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅱ.在容器乙中,起始时投入3mol N2、b mol H2,维持恒温、恒压达到平衡,测得平衡时NH3的物质的量为1.2mol.此时与容器甲中平衡状态温度相同,相同组分的体积分数都相同.
(1)容器甲10s内用H2表示的平均反应速率v(H2)=
0.024mol?L-1?s-1
0.024mol?L-1?s-1
,达平衡时N2的转化率=20%
20%
.(2)甲容器中反应的逆反应速率随时间变化的关系如图.t2时改变了某一种条件,改变的条件可能是
升高了温度
升高了温度
、增大了氨的浓度
增大了氨的浓度
(填写两项).(3)下列哪些情况表明容器乙已达平衡状态
ADE
ADE
(填字母).A.容器乙中的气体密度不再变化
B.反应的平衡常数不再变化
C.氨气的生成速率等于氮气的消耗速率的2倍
D.断裂1mol N≡N键同时断裂6mol N-H键
E.容器乙中气体的平均相对分子质量不随时间而变化
(4)b=
4.5
4.5
. 合成氨对农业生产及国防建设均具有重要意义.
合成氨对农业生产及国防建设均具有重要意义.N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是
ac
ac
(填序号).a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2的物质的量浓度不再发生变化
d.单位时间内断开a个H-H键的同时形成3a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
f. NH3的生成速率与H2的消耗速率之比为2:3
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如图所示.
①前25min 内,用H2 的浓度变化表示的化学反应平均速率是
0.12mol?L-1?min-1
0.12mol?L-1?min-1
.②在25min 末反应刚好达到平衡,则该温度下反应的平衡常数K=
0.15
0.15
(计算结果保留两位小数),达到平衡时,H2的转化率α=50%
50%
.若升高温度,该反应的平衡常数值将减小
减小
(填“增大”、“减小”或“不变”).(3)下列措施中能使n(H2)/n(NH3)增大的有
AC
AC
.A.升高温度 B.加入催化剂 C.将N2(g)从体系中分离
D.再充入1molN2和3mol H2E.体积不变,充入He(g),使体系总压强增大.