摘要:01mol / L FeCl3和 0.01mol / LKSCN等体积混合 ①加1mol / L FeCl3 红色加深 ②加1mol / L KSCN 红色加深
网址:http://m.1010jiajiao.com/timu3_id_192990[举报]
 用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:
用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:步骤1:称取试样0.100g于250mL洗净的锥形瓶中.
步骤2:加入FeCl3溶液100mL,迅速塞上胶塞,用电磁搅拌器30min.
步骤3:过滤,用水洗涤锥形瓶和滤渣各3~4次,洗液全部并入滤液中.
步骤4:将滤液稀释至500mL,再移去100mL稀释液于锥形瓶中,加入20mL硫酸和磷酸的混合酸,加0.5%二苯胺磺酸钠指示剂4滴.
步骤5:以K2Cr2O7标准溶液滴定至出现明显紫色为终点.发生的反应为:Cr2O72-+6Fe2++14H+=2Cr3++Fe3++7H2O.
步骤6:重复测定两次.
步骤7:数据处理.
(1)步骤2中加入FeCl3溶液后锥形瓶中发生反应的离子方程式为
(2)步骤3中判断滤纸上残渣已洗净的方法是
(3)实验中需用到100mL浓度为0.01mol?L-1K2Cr2O7标准溶液,配置时用到的玻璃仪器有
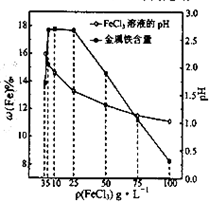
(4)科研人员确定FeCl3溶液的最佳浓度,选用100mL不同浓度的FeCl3溶液(FeCl3溶液均过量)溶解同一钛精粉试样,其余条件控制相同,得到测定结果如图所示.则FeCl3溶液的浓度[用ρ(FeCl3)表示]范围应为
在一小烧杯里混合10mL 0.01mol/L FeC13溶液和10mL 0.01mol/L KSCN溶液,溶液立即变为红色.
(1)写出反应的化学方程式:
(2)再向溶液中滴入1mol/LFeC13溶液,现象是
(3)在烧杯中加少量KC1固体(不考虑溶液体积变化),溶液颜色
查看习题详情和答案>>
(1)写出反应的化学方程式:
FeCl3+3KSCN?Fe(SCN)3+3KCl
FeCl3+3KSCN?Fe(SCN)3+3KCl
.(2)再向溶液中滴入1mol/LFeC13溶液,现象是
溶液红色加深
溶液红色加深
,平衡移动后KSCN浓度会降低
降低
.(3)在烧杯中加少量KC1固体(不考虑溶液体积变化),溶液颜色
无变化
无变化
,平衡不
不
移动.补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01mol/L、0.008mol/L等一系列浓度的[Fe(SCN)6]3-(红色)标准比色液
②样品处理
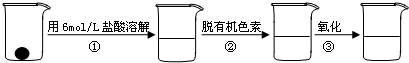
③准确量取一定体积的待测液于溶液中(比色管),加入稍过量的KSCN溶液,并稀释到10mL.
④比色,直到与选取的标准颜色一致或相近即可.
试回答下列问题:
①配制100mL0.01mol/L溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:
②步骤②脱色过程包括加入:
③比色法确定待测液的浓度其原理是
④若其补铁剂是由乳酸(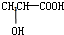 )与铁粉作用生成的,请写出该反应的化学方程式:
)与铁粉作用生成的,请写出该反应的化学方程式:
查看习题详情和答案>>
①配制0.01mol/L、0.008mol/L等一系列浓度的[Fe(SCN)6]3-(红色)标准比色液
②样品处理

③准确量取一定体积的待测液于溶液中(比色管),加入稍过量的KSCN溶液,并稀释到10mL.
④比色,直到与选取的标准颜色一致或相近即可.
试回答下列问题:
①配制100mL0.01mol/L溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:
100mL容量瓶
100mL容量瓶
、胶头滴管
胶头滴管
.②步骤②脱色过程包括加入:
活性炭
活性炭
(填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→过滤
过滤
(填操作).③比色法确定待测液的浓度其原理是
溶液颜色与物质的量浓度成正比
溶液颜色与物质的量浓度成正比
.④若其补铁剂是由乳酸(
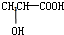 )与铁粉作用生成的,请写出该反应的化学方程式:
)与铁粉作用生成的,请写出该反应的化学方程式:2CH3CHOHCOOH+Fe→(CH3CHOHCOO)2Fe+H2↑
2CH3CHOHCOOH+Fe→(CH3CHOHCOO)2Fe+H2↑
.(2010?南开区二模)下列实验操作或对实验事实的叙述正确的是
①用稀HNO3清洗做过银镜反应实验的试管
②用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物
③读取滴定管内液体的体积,俯视读数导致读数偏小
④不慎将苯酚溶液沾到皮肤上,立即用酒精清洗
⑤向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸,以制备Fe(OH)3胶体
⑥向2.0mL浓度均为0.1mol/L的KCl、KI混合溶液中滴加1~2滴0.01mol/L AgNO3
溶液,振荡,沉淀呈黄色
(2)某课外小组对一些金属单质和化合物的性质进行研究.
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
①按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式):
置换反应
化合反应
②用石墨作电极,电解上述实验分离出的溶液,两极产生气泡.持续电解,在阴极附近的溶液中还可观察到的现象是
(2)探究氧化铜性质
①取A、B两支试管,向A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡.实验结论是
②用收集气体并测定其体积的方法探究试管A中反应的速率,必需的实验仪器有:
查看习题详情和答案>>
①③④⑥
①③④⑥
(填序号).①用稀HNO3清洗做过银镜反应实验的试管
②用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物
③读取滴定管内液体的体积,俯视读数导致读数偏小
④不慎将苯酚溶液沾到皮肤上,立即用酒精清洗
⑤向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸,以制备Fe(OH)3胶体
⑥向2.0mL浓度均为0.1mol/L的KCl、KI混合溶液中滴加1~2滴0.01mol/L AgNO3
溶液,振荡,沉淀呈黄色
(2)某课外小组对一些金属单质和化合物的性质进行研究.
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
反应结束后分离出溶液备用 |
|
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[其主要成分为Cu2(OH)2CO3] |
置换反应
2Al+6H+═2Al3++3H2↑ 或2Al+3Cu2+═2Al3++3Cu
2Al+6H+═2Al3++3H2↑ 或2Al+3Cu2+═2Al3++3Cu
化合反应
2Cu+O2+H2O+CO2═Cu2(OH)2CO3
2Cu+O2+H2O+CO2═Cu2(OH)2CO3
.②用石墨作电极,电解上述实验分离出的溶液,两极产生气泡.持续电解,在阴极附近的溶液中还可观察到的现象是
有白色沉淀生成,后沉淀逐渐溶解至消失
有白色沉淀生成,后沉淀逐渐溶解至消失
,解释此现象的离子方程式是Al3++3OH-═Al(OH)3↓ Al(OH)3+OH-═AlO2-+2H2O
Al3++3OH-═Al(OH)3↓ Al(OH)3+OH-═AlO2-+2H2O
(2)探究氧化铜性质
①取A、B两支试管,向A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡.实验结论是
CuO对H2O2的分解有催化作用
CuO对H2O2的分解有催化作用
.②用收集气体并测定其体积的方法探究试管A中反应的速率,必需的实验仪器有:
水槽(或集气瓶)、导管、量筒、秒表
水槽(或集气瓶)、导管、量筒、秒表
.下列图1中A是常见的金属,B是一种常见的无色无味的液体.C是一种有磁性的黑色氧化物,E是一种无色无味的有毒气体.根据下列图1、图2,回答下列问题:

(1)写出A+B的蒸气高温反应的化学方程式:
(2)E和N2是等电子体,电子式相似,请写出E可能的电子式:

(3)在101kPa和150℃时,可逆反应E (g)+B (g) F (g)+D (g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
F (g)+D (g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
A、升高温度B、增大压强C、加入催化剂
(4)若G是一种黄绿色单质气体,则H的水溶液呈
查看习题详情和答案>>

(1)写出A+B的蒸气高温反应的化学方程式:
3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
| ||
(2)E和N2是等电子体,电子式相似,请写出E可能的电子式:


(3)在101kPa和150℃时,可逆反应E (g)+B (g)
 F (g)+D (g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
F (g)+D (g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)BC
BC
.A、升高温度B、增大压强C、加入催化剂
(4)若G是一种黄绿色单质气体,则H的水溶液呈
酸
酸
性(填“酸、碱、中”),理由是(用离子反应方程式表示):Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
.若向0.01mol?L-1 10ml H的溶液中加入等体积等浓度的KSCN溶液,现象黄色溶液变为红色
黄色溶液变为红色
.向该混合体系中加入少量1mol?L-1 KSCN溶液,溶液颜色变深
变深
,若改加少量KCl浓溶液颜色不变
不变
(填“变深、变浅、不变”).