摘要:1.常见化学电池有 电池. 电池. 电池. 电池. 电池. 电池.
网址:http://m.1010jiajiao.com/timu3_id_192881[举报]
化学变化中既有物质变化,也有能量变化,研究化学反应有利于指导工业生产.下列是常见的化学反应:①电解熔融氯化钠 ②氮气与氢气合成氨气 ③锌与稀硫酸反应 ④煅烧石灰石.
(1)从不同角度可以对上述反应进行分类:从反应前后能量变化角度看上述反应属于放热反应的是
(2)反应③在实验室中用于制备氢气,要提高生成氢气的速率下列措施合理的是
a.加入硝酸,增大氢离子的浓度 b.用浓硫酸代替稀硫酸
c.加入少量铜粉 d.将稀硫酸的体积加倍.
反应③可以设计成原电池反应,其中负极上反应的物质是
(3)反应②是可逆反应,常应用于工业生产,升高温度正反应速率
查看习题详情和答案>>
(1)从不同角度可以对上述反应进行分类:从反应前后能量变化角度看上述反应属于放热反应的是
②③
②③
(填序号,下同);从有无电子转移角度看上述反应属于非氧化还原反应的是④
④
;从反应前后物质种类的变化角度看,①和④均属于分解
分解
反应;①和②在变化过程中断裂的化学键类型分别为离子键
离子键
、共价键
共价键
.(2)反应③在实验室中用于制备氢气,要提高生成氢气的速率下列措施合理的是
c
c
.a.加入硝酸,增大氢离子的浓度 b.用浓硫酸代替稀硫酸
c.加入少量铜粉 d.将稀硫酸的体积加倍.
反应③可以设计成原电池反应,其中负极上反应的物质是
锌
锌
,电子流向正
正
极.(3)反应②是可逆反应,常应用于工业生产,升高温度正反应速率
增大
增大
(填“增大”、“减小”或“不变”,下同),逆反应速率增大
增大
;请列举一项该反应达到平衡的标志正反应速率等于逆反应速率
正反应速率等于逆反应速率
.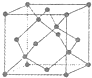 [化学--选修物质结构与性质]目前,我省多地正在积极推广使用太阳能.常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.
[化学--选修物质结构与性质]目前,我省多地正在积极推广使用太阳能.常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.(1)Cu+在基态时的价电子排布式为
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能(947kJ?mol-1)大于硒(941kJ?mol-1).请从原子结构的角度加以解释
(3)As2O3俗名砒霜,是一种剧毒物质.法医检验砒霜中毒的方法是:向试样中加入锌粉和盐酸,如果有砒霜,将生成无色气体AsH3,将气体导入热玻璃管会分解成亮黑色的“砷 镜”,这就是著名的“马氏验砷法”.请用化学方程式表示检验原理:
(4)硼酸(H3BO3)在水溶液中易结合一个OH-生成[B(OH)4]-,而体现弱酸性.
①[B(OH)4]-中B原子的杂化类型为
②[B(OH)4]-的结构式为
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原 子交替,即得到碳化硅晶体(金刚砂).
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm.立方氮化硼晶胞中含有