摘要:[练习]1.下列叙述正确的是 ( ) A.CO2分子间存在着非极性共价键 B.CO2分子内存在着极性共价键 C.SO2与H2O反应的产物是离子化合物 D.盐酸中含H+和Cl-故HCl为离子化合物2.下列说法是否正确?并举例说明. (1)离子化合物中可能含有共价键. (2)共价化合物中可能含有离子键. (3)以极性键结合的分子一定是极性分子. (4)非极性分子中一定含有非极性键. (5)两个非金属原子间不可能形成离子键. (6)非金属原子间不可能形成离子键. (7)非极性键只存在于双原子单质分子里. (8)活泼金属和活泼非金属一定形成离子化合物. (9)元素的性质越活泼.单质的性质也一定越活泼.
网址:http://m.1010jiajiao.com/timu3_id_192523[举报]
在等温等容条件下,有反应2A(g)+2B(g)?C(g)+3D(g),现分别从两个途径建立平衡:
Ⅰ.A、B的起始浓度均为2mol?L-1;
Ⅱ.C、D的起始浓度分别为2mol?L-1,6mol?L-1
下列叙述正确的是( )
Ⅰ.A、B的起始浓度均为2mol?L-1;
Ⅱ.C、D的起始浓度分别为2mol?L-1,6mol?L-1
下列叙述正确的是( )
(2009?汕头二模)几种短周期元素的原子半径及主要化合价见下表:
|
查看习题详情和答案>>
对可逆反应N2 (g)+3H2(g)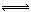 2 NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是( )
2 NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是( )
| A.达到化学平衡时,若增加容器体积,则正反应速率减小 ,逆反应速率增大 |
| B.若单位时间内生成x mol N2的同时,消耗2x molNH3,则反应达到平衡状态 |
| C.达到化学平衡时,2v正(H2)=3v逆(NH3) |
| D.加入催化剂,正反应速率增大,逆反应速率不变 |
几种短周期元素的原子半径及主要化合价见下表:
元素代号 | K | L | M | Q | R | T | N |
原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
下列叙述正确的是( )
A.K、L、M三元素的金属性逐渐增强
B.在RCl2分子中,各原子均满足8电子的稳定结构
C.Q元素的最高价氧化物为电解质,其水溶液能够导电
D.K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键
请根据元素周期律和元素周期表回答以下问题。
(1)下列叙述正确的是( )
A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.室温时,0族元素的单质都是气体
D.元素周期表中从ⅢB到ⅡB族这10个纵行的元素都是金属元素
(2)X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是( )
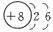
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.四种元素的单质中,Z单质的熔沸点最高
D.W的单质能与水反应,生成一种具有漂白性的物质
(3)铊(Tl)位于元素周期表的ⅢA族。有的同学预测:单质铊能与盐酸反应放出氢气,氢氧化铊是两性氢氧化物。你认为这位同学的预测正确吗?__________________________________________
查看习题详情和答案>>