摘要:元素的金属性强.元素的失电子能力 .单质的还原性 .其阳离子的氧化性 .如钠和镁. 元素的非金属性强.元素的原子得电子能力 .单质的氧化性 .其阴离子的还原性 .如硫和氯. [练习] 1.下列变化的比较, 不正确的是( ) A.酸性强弱: HClO4> H2SO4> H3PO4 > H4SiO4 B.原子半径大小: Na > S > O C.碱性强弱: KOH > NaOH > LiOH D.还原性强弱: F- > Cl-> I- 2.硒是人体肝脏和肾脏的组成元素之一.现在含有元素硒(Se) 的保健品已经进入市场, 已知它与氧元素同族, 与 K 同周期, 关于硒的说法中不正确的是 ( ) A.原子序数为 34 B.最高价氧化物的水化物的分子式为:H2SeO4 C.Se 的非金属性比 Br 弱 D.气态氢化物的稳定性比硫化氢气体强 3.X.Y是短周期元素.两者能组成化合物X2Y3 ,如果X的核电荷数为n.则Y核电荷数不可能是( ) A.n+11 B.n-6 C.n+3 D.n+4
网址:http://m.1010jiajiao.com/timu3_id_192512[举报]
应用元素周期律分析下列推断,其中正确的组合是( )
①碱金属单质的熔点随原子序数的增大而降低
②Cs是第ⅠA族元素,Cs失电子能力比Na的强
③砹(At)是第VIIA族,其氢化物的稳定性大于HCl
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱.
①碱金属单质的熔点随原子序数的增大而降低
②Cs是第ⅠA族元素,Cs失电子能力比Na的强
③砹(At)是第VIIA族,其氢化物的稳定性大于HCl
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱.
| A、①③⑤ | B、①②⑤ | C、②③⑤ | D、①②④ |
下面元素周期表被分成a、b、c、d四个区域,下列有关说法正确的是( )
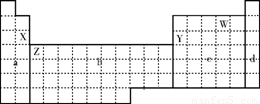
A.元素周期表中b区域全部是金属元素
B.X、Y两元素相比较,失电子能力较强的是X,可以验证该结论的实验是将在空气中放置已久的这两种元素的块状单质分别放入热水中
C.Z元素代表的是Ca元素
D.W元素是非金属元素,该元素对应的氢化物显酸性
查看习题详情和答案>>
根据元素周期表1~20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有 种,失电子能力最强的元素是 (填元素符号)。
(2)形成化合物种类最多的两种元素是 (填元素符号)。
(3)第三周期中,原子半径最大的元素的单质(稀有气体除外)与氧气反应生成的所有化合物的化学式为 。
(4)推测P、O元素最简单气态氢化物的稳定性较强的是 (填化学式)。
(5)第ⅢA族某元素最高价氧化物对应水化物呈两性,该水化物与烧碱溶液反应的离子方程式为 。
查看习题详情和答案>>