摘要:通过刚才的分析你能总结一下影响物质体积大小的因素有哪些吗?
网址:http://m.1010jiajiao.com/timu3_id_191988[举报]
铁可以作为苯与溴发生取代反应的催化剂,该反应是放热反应。有三个研究性学习小组,为了探究苯与溴发生的反应是取代反应,分别设计了图4-4所示甲、乙、丙三套实验装置(图中夹持装置的仪器均未画出)。其中,圆底烧瓶上的长导管可以使苯和部分溴蒸气冷凝回流。请你回答下列问题:
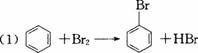
图4-4
(F、J装置中的导气管不能伸入到溶液内)
(1)苯与溴发生取代反应的化学方程式:_________________________________________。
(2)甲、乙、丙三套装置中不能达到实验目的的装置是________________,其原因是___________________________________________________________________。
(3)能够达到实验目的,但是实验装置存在某些缺陷,请你选出有缺陷的装置,并将存在的缺陷相应地填写在下表中,可以不填满。
装置的名称 | 存在的缺陷 |
|
|
|
|
|
|
(4)请你根据(3)中的分析,重新组装一套比较完善的实验装置来完成实验,用实验装置的字母写出组装的顺序(按气流从左至右的方向)____________________。
查看习题详情和答案>>20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.分析图中信息,回答下列问题:
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中 的△H表示生成1mol产物的数据).根据图二回答下列问题:
①P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式
②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2
查看习题详情和答案>>
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol
.在反应体系中加入催化剂,E1和E2的变化是:E1减小
减小
,E2减小
减小
(填“增大”、“减小”或“不变”),对反应热是否有影响?无影响
无影响
,原因是催化剂只降低反应所需的活化能,不能改变反应物的总能量和生成物总能量之差,即反应热不变
催化剂只降低反应所需的活化能,不能改变反应物的总能量和生成物总能量之差,即反应热不变
.(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中 的△H表示生成1mol产物的数据).根据图二回答下列问题:
①P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式
P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol
P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol
.②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2
等于
等于
△H1(填“大于”、“小于”或“等于”),原因是根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的
根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的
.
(2010?江苏)对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备.

一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h.反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯.
(l)上述实验中过滤的目的是
(2)滤液在分液漏斗中洗涤静置后,有机层处于
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果.
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有
查看习题详情和答案>>

一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h.反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯.
(l)上述实验中过滤的目的是
回收NaHSO4
回收NaHSO4
.(2)滤液在分液漏斗中洗涤静置后,有机层处于
下
下
层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有分液漏斗上口塞子未打开
分液漏斗上口塞子未打开
.(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果.
| 催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
| n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
0.32
0.32
.②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是
甲苯硝化主要得到对硝基甲苯和邻硝基甲苯
甲苯硝化主要得到对硝基甲苯和邻硝基甲苯
.③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有
在硝化产物中对硝基甲苯比例提高
在硝化产物中对硝基甲苯比例提高
、催化剂用量少且能循环使用
催化剂用量少且能循环使用
.(2009?茂名二模)双酚-A的二甲基丙烯酸酯是一种能使人及动物的内分泌系统发生紊乱,导致生育及繁殖异常的环境激素,其结构简式为:
它在一定条件下水解可生成双酚-A和羧酸H两种物质.
Ⅰ.(1)双酚-A的分子式为
(2)下列关于双酚-A的叙述中正确的是
A.与苯酚互为同系物
B.可以和Na2CO3溶液反应,放出CO2气体
C.分子中最多有8个碳原子在同一平面上
D.1mol双酚-A与浓溴水反应,最多可以消耗Br2的物质的量为4mol
Ⅱ.已知与(CH3)3COH结构相似的醇不能被氧化为醛或酸.羧酸H可以由烯烃C通过以下途径制得(有的反应条件没有标出):
(3)C的结构简式
 .
.
(4)G中所含官能团为
(5)羧酸H与甲醇反应后得到的酯,能形成一种高分子化合物,可用于制造高级光学仪器透镜,请写出该酯在一定条件下生成此高分子化合物的化学反应方程式:


 .
.
查看习题详情和答案>>

它在一定条件下水解可生成双酚-A和羧酸H两种物质.
Ⅰ.(1)双酚-A的分子式为
C15H16O2
C15H16O2
.(2)下列关于双酚-A的叙述中正确的是
D
D
(填写字母).A.与苯酚互为同系物
B.可以和Na2CO3溶液反应,放出CO2气体
C.分子中最多有8个碳原子在同一平面上
D.1mol双酚-A与浓溴水反应,最多可以消耗Br2的物质的量为4mol
Ⅱ.已知与(CH3)3COH结构相似的醇不能被氧化为醛或酸.羧酸H可以由烯烃C通过以下途径制得(有的反应条件没有标出):

(3)C的结构简式


(4)G中所含官能团为
羟基、羧基
羟基、羧基
(填名称),⑤的反应类型为消去反应
消去反应
.(5)羧酸H与甲醇反应后得到的酯,能形成一种高分子化合物,可用于制造高级光学仪器透镜,请写出该酯在一定条件下生成此高分子化合物的化学反应方程式:

| 催化剂 |


| 催化剂 |
