网址:http://m.1010jiajiao.com/timu3_id_19192[举报]

查阅资料:金属铜长时间放置在空气中,与氧气等物质发生复杂的化学反应,形成“铜绿”.
空气中氮气和稀有气体的化学性质稳定,常温下难与其他物质反应.
猜想与假设:经过思考和推理,小强认为“铜绿”的组成元素可能是铜、氧、氢、碳元素.
实验与结论:小强按实验设计连接A→
| 实验操作 | 实验现象 | 实验结论 |
| 实验Ⅰ:将一定量绿色固体装入反应容器中,进行实验 | ①白色无水硫酸铜变蓝色 | 产物中有 H2O |
| ② 澄清石灰水变浑浊 |
产物中有二氧化碳 写出检验二氧化碳的化学方程式: CO2+Ca(OH)2═CaCO3↓+H2O | |
| ③绿色固体变黑色 |
(1)小李根据碱式碳酸铜的化学式对黑色固体产物做出以下猜想:①可能是碳,②可能是氧化铜.③可能是碳和氧化铜的混合物.他做出以上猜想的依据是
(2)小王根据碳的化学性质,认为猜想③可以排除,理由是
(3)为验证①、②猜想,他们设计如下实验方案:向盛有少量黑色固体的试管中加入足量的稀硫酸,振荡,待完全反应后静置观察现象.若猜想①正确,现象应该是
通过实验探究得知“铜绿”是由铜、氧、氢、碳四种元素组成.
反思与应用:大多数金属的锈蚀与铁、铜的锈蚀相似,金属的锈蚀给人类带来了巨大的损失,请写出防止金属锈蚀的一种方法:
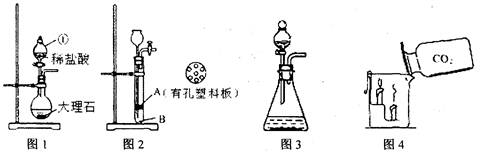
实验室选用下列装置制取气体.根据要求回答问题:

(1)图l中仪器①的名称________,该装置中发生的化学方程式为________.图1装置也可以用于实验室制氧气,写出发生的化学方程式为________,该反应的类型是________.(填“化合反应”或“分解反应”)
(2)小杨同学将MnO2,与水泥按一定比例加水混合、凝固,制作成小块状固体,加入图2装置中制氧气,以方便实验结束后回收二氧化锰.实验前检查该装置气密性的方法是:打开旋塞,从长颈漏斗口注水至________,关闭旋塞,继续注水,使漏斗中液面略高于试管中液面,一段时间后,高度差不变,说明气密性良好.其中块状固体应放置在________处(填“A”或“B”).利用图2装置反应一段时间后,需停止反应,其操作是________.
(3)反应结束后冷却,对制取氧气后的固体残渣(假定已完全反应)作如下回收处理:
①通过以下四步实验操作回收二氧化锰.正确操作的先后顺序是________(填写序号).
A.烘干
B.溶解
C.过滤
D.洗涤
②过滤、蒸发时都需用到的仪器是________(填序号).
A.酒精灯
B.烧杯
C.玻璃棒
D.漏斗
(4)若用装置图3制取气体过程中反应剧烈,从实验安全角度考虑,可采取的措施有________(填序号).
①用容积较小的锥形瓶
②控制液体的滴加速度
③加热反应物
④降低反应物浓度
(5)图4中,把二氧化碳气体慢慢倒入放有燃着的蜡烛的烧杯中,下层蜡烛先灭,说明二氧化碳具有________性质.这一性质在实际生活中的应用为________.
(6)在没有现成的二氧化碳气体发生器情况下,请你选用下图中部分仪器装配成一个能随开随用随关随停的二氧化碳气体发生装置,应选用合理的仪器是________.

(1)(4分)图l中仪器①的名称________,该装置中发生的化学方程式为_____________。图1装置也可以用于实验室制氧气,写出发生的化学方程式为_______________________
_________________________,该反应的类型是________________。(填“化合反应”或“分解反应”)
(2)(3分)小杨同学将MnO2,与水泥按一定比例加水混合、凝固,制作成小块状固体,加入图2装置中制氧气,以方便实验结束后回收二氧化锰。实验前检查该装置气密性的方法是:打开旋塞,从长颈漏斗口注水至________________________,关闭旋塞,继续注水,使漏斗中液面略高于试管中液面,一段时间后,高度差不变,说明气密性良好。其中块状固体应放置在_______处(填“A”或“B”)。利用图2装置反应一段时间后,需停止反应,其操作是________________________________。
(3)(2分)反应结束后冷却,对制取氧气后的固体残渣(假定已完全反应)作如下回收处理:
①通过以下四步实验操作回收二氧化锰。正确操作的先后顺序是_________(填写序号)。
A.烘干 B.溶解 C.过滤 D.洗涤
②过滤、蒸发时都需用到的仪器是________(填序号)。
A.酒精灯 B.烧杯 C.玻璃棒 D.漏斗
(4)(1分)若用装置图3制取气体过程中反应剧烈,从实验安全角度考虑,可采取的措施有________(填序号)。
①用容积较小的锥形瓶 ②控制液体的滴加速度
③加热反应物 ④降低反应物浓度
(5)(2分)图4中,把二氧化碳气体慢慢倒入放有燃着的蜡烛的烧杯中,下层蜡烛先灭,说明二氧化碳具有________________________性质。这一性质在实际生活中的应用为_____
___________________。
(6)(2分)在没有现成的二氧化碳气体发生器情况下,请你选用下图中部分仪器装配成一个能随开随用随关随停的二氧化碳气体发生装置,应选用合理的仪器是________________。
[查阅资料]资料一:在常温下,测得浓度均为a%的下列六种溶液的pH大小情况:
| 溶质 | H2SO4 | HCl | H2S | H2CO3 | HClO |
| pH | 小→大 | ||||
A.H2SO4+2NaHCO3=2NaCl+2H2O+2CO2↑ B.2HCl+CaS=CaC2l+H2S↑
C.CO2+H2O+Ca(ClO)2=CaCO3↓+2HClO D.H2S+CuSO4=H2SO4+CuS↓
资料二:CuS是黑褐色无定形粉末或粒状物,不溶于浓盐酸,不溶于水和硫化钠溶液.
[实验探究]小平同学为了得到纯净的二氧化碳,设计了如下装置,请你分析:
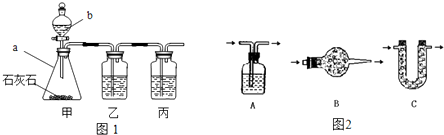
[制取CO2]利用图1、与图2干燥装置制得纯净干燥的CO2.
(1)仪器a的名称是
(2)装置丙盛有足量的饱和NaHCO3溶液,目的是除去
(3)利用图2干燥装置干燥气体,常见干燥剂有①浓硫酸②无水氯化钙③碱石灰④生石灰若选用A装置,则A装置中放入药品
(4)小明同学为了计算这种大理石中含碳酸钙质量分数,进行了如下定量实验:
| 实验步骤 | I将适量盐酸加入烧杯中并称量 | II称取少量大理石样品加入烧杯中,使之与过量稀盐酸反应 | III待反应完全后,称重 |
| 实验图示 | 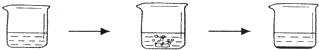 | ||
| 实验数据 | 烧杯和盐酸的质量为100.0g | 大理石样的质量为12.0g | 烧杯和其中混合物的质量为107.6g |