题目内容
CaCO3广泛存在于自然界,是一种重要的化工原料.某种大理石除主要成分为CaCO3外,还有少量的硫化物.小平和小明同学用这种大理石和稀盐酸反应,分别开展以下探究,请你参与探究并回答相关问题.
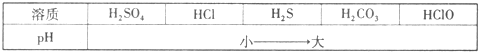
[查阅资料]资料一:在常温下,测得浓度均为a%的下列六种溶液的pH大小情况:
表中pH大小情况揭示出复分解反应的一条规律,即较强酸发生类似反应可以生成较弱酸.下列反应均能发生,其中不符合该规律的是
A.H2SO4+2NaHCO3=2NaCl+2H2O+2CO2↑ B.2HCl+CaS=CaC2l+H2S↑
C.CO2+H2O+Ca(ClO)2=CaCO3↓+2HClO D.H2S+CuSO4=H2SO4+CuS↓
资料二:CuS是黑褐色无定形粉末或粒状物,不溶于浓盐酸,不溶于水和硫化钠溶液.
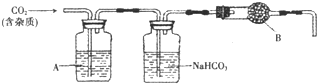
[实验探究]小平同学为了得到纯净的二氧化碳,设计了如下装置,请你分析:
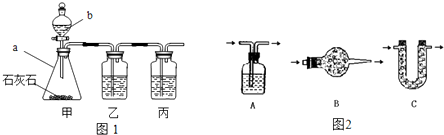
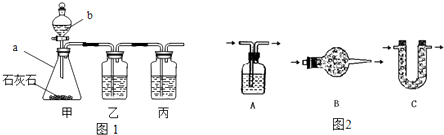
[制取CO2]利用图1、与图2干燥装置制得纯净干燥的CO2.
(1)仪器a的名称是
(2)装置丙盛有足量的饱和NaHCO3溶液,目的是除去
(3)利用图2干燥装置干燥气体,常见干燥剂有①浓硫酸②无水氯化钙③碱石灰④生石灰若选用A装置,则A装置中放入药品
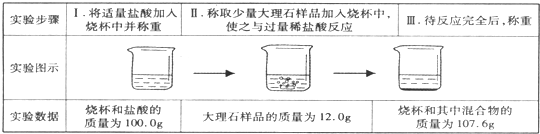
(4)小明同学为了计算这种大理石中含碳酸钙质量分数,进行了如下定量实验:
小明同学通过分析计算,得出结论:该实验中生成的二氧化碳的质量是4.4g.大理石样品纯度为83.3%.请你评价他的结论是否正确
[查阅资料]资料一:在常温下,测得浓度均为a%的下列六种溶液的pH大小情况:
| 溶质 | H2SO4 | HCl | H2S | H2CO3 | HClO |
| pH | 小→大 | ||||
D
D
(填字母A.H2SO4+2NaHCO3=2NaCl+2H2O+2CO2↑ B.2HCl+CaS=CaC2l+H2S↑
C.CO2+H2O+Ca(ClO)2=CaCO3↓+2HClO D.H2S+CuSO4=H2SO4+CuS↓
资料二:CuS是黑褐色无定形粉末或粒状物,不溶于浓盐酸,不溶于水和硫化钠溶液.
[实验探究]小平同学为了得到纯净的二氧化碳,设计了如下装置,请你分析:

[制取CO2]利用图1、与图2干燥装置制得纯净干燥的CO2.
(1)仪器a的名称是
锥形瓶
锥形瓶
,仪器b的名称是分液漏斗
分液漏斗
.装置甲中主要反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.(2)装置丙盛有足量的饱和NaHCO3溶液,目的是除去
氯化氢气体
氯化氢气体
.装置丙中主要反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
.装置乙中盛有的物质是CuSO4
CuSO4
溶液.现象:出现黑褐色沉淀
出现黑褐色沉淀
.(3)利用图2干燥装置干燥气体,常见干燥剂有①浓硫酸②无水氯化钙③碱石灰④生石灰若选用A装置,则A装置中放入药品
①
①
(选择序号);若选用B装置,则B装置中放入药品②
②
(选择序号).(4)小明同学为了计算这种大理石中含碳酸钙质量分数,进行了如下定量实验:
| 实验步骤 | I将适量盐酸加入烧杯中并称量 | II称取少量大理石样品加入烧杯中,使之与过量稀盐酸反应 | III待反应完全后,称重 |
| 实验图示 |  | ||
| 实验数据 | 烧杯和盐酸的质量为100.0g | 大理石样的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
错误
错误
,并简述理由大理石中含有硫化物,硫化物与盐酸反应会生成硫化氢气体逸出,把生成的气体全部作为二氧化碳,使碳酸钙质量偏大,造成碳酸钙的质量分数偏大
大理石中含有硫化物,硫化物与盐酸反应会生成硫化氢气体逸出,把生成的气体全部作为二氧化碳,使碳酸钙质量偏大,造成碳酸钙的质量分数偏大
.分析:由信息可知酸性强的酸能制取酸性弱的酸分析;
(1)根据仪器的名称考虑,根据方程式的写法考虑;
(2)饱和NaHCO3溶液能将氯化氢气体反应掉,但不和二氧化碳反应;装置乙中盛有的物质是硫酸铜溶液,目的是将生成的硫化氢气体反应掉,实验现象是出现黑褐色沉淀;
(3)根据干燥剂的性质分析;
(4)根据大理石中含有硫化物,硫化物与盐酸反应会生成硫化氢气体,该方法把生成的气体全部作为二氧化碳,使计算出碳酸钙质量偏大发分析.
(1)根据仪器的名称考虑,根据方程式的写法考虑;
(2)饱和NaHCO3溶液能将氯化氢气体反应掉,但不和二氧化碳反应;装置乙中盛有的物质是硫酸铜溶液,目的是将生成的硫化氢气体反应掉,实验现象是出现黑褐色沉淀;
(3)根据干燥剂的性质分析;
(4)根据大理石中含有硫化物,硫化物与盐酸反应会生成硫化氢气体,该方法把生成的气体全部作为二氧化碳,使计算出碳酸钙质量偏大发分析.
解答:解:资料一:由信息可知酸性强的酸能制取酸性弱的酸,因H2S的酸性比硫酸酸性弱,故错误;
故选D;
资料二:
(1)仪器a是锥形瓶,仪器b是分液漏斗,装置甲中主要是碳酸钙和稀盐酸反应,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)饱和NaHCO3溶液能将氯化氢气体反应掉,但不和二氧化碳反应;装置丙中主要反应是碳酸氢钠和盐酸反应,反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑;装置乙中盛有的物质是硫酸铜溶液,目的是将生成的硫化氢气体反应掉,实验现象是出现黑褐色沉淀;
故答案为:氯化氢气体;NaHCO3+HCl=NaCl+H2O+CO2↑;CuSO4;出现黑褐色沉淀;
(3)若选用A装置,A装置中盛放的是液体,因此应盛放浓硫酸干燥;若选用B装置,则B装置中盛放的是固体,应盛放无水氯化钙干燥;
故答案为:①;②;
(4)大理石中含有硫化物,硫化物与盐酸反应会生成硫化氢气体,该方法把生成的气体全部作为二氧化碳,使计算出碳酸钙质量偏大,造成碳酸钙的质量分数偏大;
故答案为:错误;大理石中含有硫化物,硫化物与盐酸反应会生成硫化氢气体逸出,把生成的气体全部作为二氧化碳,使碳酸钙质量偏大,造成碳酸钙的质量分数偏大.
故选D;
资料二:
(1)仪器a是锥形瓶,仪器b是分液漏斗,装置甲中主要是碳酸钙和稀盐酸反应,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)饱和NaHCO3溶液能将氯化氢气体反应掉,但不和二氧化碳反应;装置丙中主要反应是碳酸氢钠和盐酸反应,反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑;装置乙中盛有的物质是硫酸铜溶液,目的是将生成的硫化氢气体反应掉,实验现象是出现黑褐色沉淀;
故答案为:氯化氢气体;NaHCO3+HCl=NaCl+H2O+CO2↑;CuSO4;出现黑褐色沉淀;
(3)若选用A装置,A装置中盛放的是液体,因此应盛放浓硫酸干燥;若选用B装置,则B装置中盛放的是固体,应盛放无水氯化钙干燥;
故答案为:①;②;
(4)大理石中含有硫化物,硫化物与盐酸反应会生成硫化氢气体,该方法把生成的气体全部作为二氧化碳,使计算出碳酸钙质量偏大,造成碳酸钙的质量分数偏大;
故答案为:错误;大理石中含有硫化物,硫化物与盐酸反应会生成硫化氢气体逸出,把生成的气体全部作为二氧化碳,使碳酸钙质量偏大,造成碳酸钙的质量分数偏大.
点评:此题很好的将化学实验与其他化学知识有机地结合于一体,综合考查学生的能力和素质;考查知识也是从简单到复杂、从单一到综合.

练习册系列答案
相关题目
CaCO3广泛存在于自然界,是一种重要的化工原料.某种大理石除主要成分为CaCO3外,还有少量的硫化物.小茜和小明同学用这种大理石和稀盐酸反应,分别开展以下探究,请你参与探究并回答相关问题.
【查阅资料】
资料一:已知复分解反应CaCO3+2HCI=CO2↑+H2O+CaCl2可自发进行.在常温下,测得浓度均为a%的下列六种溶液的pH大小情况:
表中pH大小情况揭示出复分解反应的一条规律,即较强酸发生类似反应可以生成较弱酸.下列反应均能发生,其中不符合该规律的是______(填字母).
A、H2SO4+2NaHCO3=2NaCl+2H2O+2CO2↑ B、2HCl+CaS=CaCl2+H2S↑
C、CO2+H2O+Ca(ClO)2=CaCO3↓+2HClO D、H2S+CuSO4=H2SO4+CuS↓
资料二:常见干燥剂有①浓硫酸②无水氯化钙③碱石灰④生石灰⑤五氧化二磷
【实验探究】
小茜同学为了得到纯净的二氧化碳,设计了如下装置,请你分析:

(1)制备的CO2气体中,可能含有的杂质是______;
(2)上述装置中,A是______溶液,NaHCO3溶液可以吸收______;
(3)上述装置中,B物质的名称可能是______;
(4)用这个实验得到的气体测定CO2的相对分子质量,如果B物质失效,测定结果______ (填“偏高“、“偏低“或“不受影响“);
(5)小明同学为了计算这种大理石中含碳酸钙质量分数,进行了如下定量实验:
小明同学通过分析计算,得出结论:该实验中生成的二氧化碳的质量是4.4g.大理石样品纯度为83.3%.请你评价他的结论是否正确______(填“正确“或“错误“),并简述理由______.
【查阅资料】
资料一:已知复分解反应CaCO3+2HCI=CO2↑+H2O+CaCl2可自发进行.在常温下,测得浓度均为a%的下列六种溶液的pH大小情况:
| 溶质 | H2SO4 | HCl | H2S | H2CO3 | HClO |
| pH | 小→大 | ||||
A、H2SO4+2NaHCO3=2NaCl+2H2O+2CO2↑ B、2HCl+CaS=CaCl2+H2S↑
C、CO2+H2O+Ca(ClO)2=CaCO3↓+2HClO D、H2S+CuSO4=H2SO4+CuS↓
资料二:常见干燥剂有①浓硫酸②无水氯化钙③碱石灰④生石灰⑤五氧化二磷
【实验探究】
小茜同学为了得到纯净的二氧化碳,设计了如下装置,请你分析:

(1)制备的CO2气体中,可能含有的杂质是______;
(2)上述装置中,A是______溶液,NaHCO3溶液可以吸收______;
(3)上述装置中,B物质的名称可能是______;
(4)用这个实验得到的气体测定CO2的相对分子质量,如果B物质失效,测定结果______ (填“偏高“、“偏低“或“不受影响“);
(5)小明同学为了计算这种大理石中含碳酸钙质量分数,进行了如下定量实验:
| 实验步骤 | I.将适量盐酸加入烧杯中并称重 | II.称取少量大理石样品加入烧杯中,使之与过量稀盐酸反应 | III.待完全反应后,称重 |
| 实验图示 |  | ||
| 实验数据 | 烧杯和盐酸的质量为100.0g | 大理石样品的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
 CaCO3广泛存在于自然界,是一种重要的化工原料.某种大理石除主要成分为CaCO3外,还含有少量的硫化物.小茜和小明同学用这种大理石和稀盐酸反应,分别开展以下探究,请你参与探究并回答相关问题.
CaCO3广泛存在于自然界,是一种重要的化工原料.某种大理石除主要成分为CaCO3外,还含有少量的硫化物.小茜和小明同学用这种大理石和稀盐酸反应,分别开展以下探究,请你参与探究并回答相关问题.