摘要:小明家购买一瓶白醋.标签上注明醋酸的质量分数≥5%.小明想.这瓶白醋中醋酸的含量是否与标签的标注相符?请你与小明一起.用有关酸碱的知识.定量测定白醋中醋酸含量 实验原理 (1)用已知浓度的氢氧化钠溶液和醋酸反应的化学方程式为: CH3COOH+NaOH === CH3COONa+H2O (2)在混合溶液中.当醋酸和氢氧化钠完全中和时.再增加一滴氢氧化钠溶液.溶液就呈碱性.而一滴氢氧化钠溶液约为0.05mL.计算时可忽略不计 实验步骤 ①选用 量筒取12mL白醋倒入烧杯中.再加入20mL蒸馏水稀释. A.10mL B.25 mL C.50 mL D.100 mL ②量取45.0mL溶质质量分数为1.0%的氢氧化钠溶液.逐滴的滴加到稀释后的白醋中.同时不断搅拌烧杯中的溶液.滴至恰好完全反应.剩余氢氧化钠溶液5.0mL. 数据处理 根据实验数据.计算出白醋中醋酸的含量是 .与标签的标注 符. 交流反思 (1)在实验步骤①中.加适量水稀释白醋.对实验结果 影响 理由 . (2)在实验步骤①中量取白醋时俯视.则测定的结果 (3)在实验步骤②中.小明确定醋酸和氢氧化钠已恰好完全中和的方法是 .
网址:http://m.1010jiajiao.com/timu3_id_19186[举报]
小明家购买一瓶白醋,标签上注明醋酸的质量分数≥5%。小明想,这瓶白醋中醋酸的含量是否与标签的标注相符?请你与小明一起,用有关酸碱的知识,定量测定白醋中醋酸含量
实验原理
(1)用已知浓度的氢氧化钠溶液和醋酸反应的化学方程式为: CH3COOH+NaOH === CH3COONa+H2O
(2)在混合溶液中,当醋酸和氢氧化钠完全中和时,再增加一滴氢氧化钠溶液,溶液就呈碱性,而一滴氢氧化钠溶液约为0.05mL,计算时可忽略不计
实验步骤
①选用 量筒取12mL白醋(密度近似为1.0g/mL)倒入烧杯中,再加入20mL蒸馏水稀释。
A.10mL B.25 mL C.50 mL D.100 mL
②量取45.0mL溶质质量分数为1.0%(密度近似为1.0g/mL)的氢氧化钠溶液,逐滴的滴加到稀释后的白醋中,同时不断搅拌烧杯中的溶液。滴至恰好完全反应,剩余氢氧化钠溶液5.0mL。数据处理根据实验数据,计算出白醋中醋酸的含量是 ,与标签的标注 (填相或不相)符。
交流反思
(1)在实验步骤①中,加适量水稀释白醋,对实验结果 (有或无)影响理由 。
(2)在实验步骤①中量取白醋时俯视,则测定的结果 (填偏高或偏低)
(3)在实验步骤②中,小明确定醋酸和氢氧化钠已恰好完全中和的方法是 。
查看习题详情和答案>>
实验原理
(1)用已知浓度的氢氧化钠溶液和醋酸反应的化学方程式为: CH3COOH+NaOH === CH3COONa+H2O
(2)在混合溶液中,当醋酸和氢氧化钠完全中和时,再增加一滴氢氧化钠溶液,溶液就呈碱性,而一滴氢氧化钠溶液约为0.05mL,计算时可忽略不计
实验步骤
①选用 量筒取12mL白醋(密度近似为1.0g/mL)倒入烧杯中,再加入20mL蒸馏水稀释。
A.10mL B.25 mL C.50 mL D.100 mL
②量取45.0mL溶质质量分数为1.0%(密度近似为1.0g/mL)的氢氧化钠溶液,逐滴的滴加到稀释后的白醋中,同时不断搅拌烧杯中的溶液。滴至恰好完全反应,剩余氢氧化钠溶液5.0mL。数据处理根据实验数据,计算出白醋中醋酸的含量是 ,与标签的标注 (填相或不相)符。
交流反思
(1)在实验步骤①中,加适量水稀释白醋,对实验结果 (有或无)影响理由 。
(2)在实验步骤①中量取白醋时俯视,则测定的结果 (填偏高或偏低)
(3)在实验步骤②中,小明确定醋酸和氢氧化钠已恰好完全中和的方法是 。
小玲家购买了一瓶白醋,标签上注明醋酸的质量分数≥5%。小玲想:这瓶白醋中醋酸的含量是否与标注相符?请你和小玲一起用酸碱的知识来测定白醋中醋酸的含量。
[实验原理]醋酸与氢氧化钠溶液反应的化学方程式: CH3COOH+NaOH==CH3COONa+H2O
[实验过程]将40mL溶质质量分数为1%的氢氧化钠溶液(密度近似为1.0 g/mL),逐滴加到12mL白醋(密度近似为1.0 g/mL)中,恰好完全中和。
[交流反思]在实验中如果盛白醋的烧杯中事先残留有蒸馏水,对实验结果有无影响?为什么?
[数据处理]根据实验数据,通过计算判断白醋中醋酸的含量是否与标签的标注相符?
查看习题详情和答案>>
[实验原理]醋酸与氢氧化钠溶液反应的化学方程式: CH3COOH+NaOH==CH3COONa+H2O
[实验过程]将40mL溶质质量分数为1%的氢氧化钠溶液(密度近似为1.0 g/mL),逐滴加到12mL白醋(密度近似为1.0 g/mL)中,恰好完全中和。
[交流反思]在实验中如果盛白醋的烧杯中事先残留有蒸馏水,对实验结果有无影响?为什么?
[数据处理]根据实验数据,通过计算判断白醋中醋酸的含量是否与标签的标注相符?
30、小明家购买了一瓶白醋,标签上注明醋酸的质量分数≥5%.小明想,这瓶白醋中醋酸的含量是否与标签的标注相符?
请你与小明一起,用有关酸碱的知识,定量测定白醋中醋酸的含量.
实验原理:
(1)用已知浓度的氢氧化钠溶液和醋酸反应,反应的化学方程式为:
CH3COOH+NaOH=CH3COONa+H2O.
(2)在混合溶液中,当醋酸和氢氧化钠完全中和时,再增加1滴氢氧化钠溶液,溶液就呈碱性,而1滴氢氧化钠溶液约为0.05 mL,对测定结果的影响很小,可忽略不计.
实验步骤:
①用__________取12.0 mL白醋(密度近似为1.0 g/mL),倒入烧杯中,再加入20 mL蒸馏水稀释.
②量取45.0 mL溶质质量分数为1.0%的氢氧化钠溶液(密度近似为1.0 g/mL),用胶头滴管取该氢氧化钠溶液,逐滴地滴加到稀释后的白醋中,同时不断地搅拌烧杯中的溶液,至恰好完全反应,剩余氢氧化钠溶液5.0 mL.
交流反思:
(1)在实验步骤①中,加适量水稀释白醋,对实验结果有无影响?为什么?
(2)在实验步骤②中,小明如何确定醋酸和氢氧化钠已完全中和?
数据处理:根据实验数据,通过计算判断白醋中醋酸的含量是否与标签的标注相符.
(2005
·威海市)小明家购买了一瓶白醋,标签上注明醋酸的质量分数≥5%.小明想,这瓶白醋中醋酸的含量是否与标签的标注相符?请你与小明一起,用有关酸碱的知识,定量测定白醋中醋酸的含量.[
实验原理](1)用已知浓度的氢氧化钠溶液和醋酸反应,反应的化学方程式为:
(2)
在混合溶液中,当醋酸和氢氧化钠完全中和时,再增加1滴氢氧化钠溶液,溶液就呈碱性,而1滴氢氧化钠溶液约为0.05mL,对测定结果的影响很小,可忽略不计.[
实验步骤]①用________量取12.0mL白醋(密度近似为1.0g/mL),倒入烧杯中,再加入20mL蒸馏水稀释.②量取45.0mL溶质的质量分数为1.0%的氢氧化钠溶液(密度近似为1.02/mL),用胶头滴管取该氢氧化钠溶液,逐滴滴加到稀释后的白醋中,同时不断地搅拌烧杯中的溶液.滴至恰好完全反应,剩余氢氧化钠溶液5.0mL.[
交流反思](1)在实验步骤①中,加适量的水稀释白醋,对实验结果有无影响?为什么?(2)
在实验步骤②中,小明如何确定醋酸和氢氧化钠已完全中和?[
数据处理]根据实验数据,通过计算判断白醋中醋酸的含量是否与标签的标注相符? 查看习题详情和答案>>
小明家购买了一瓶白醋,标签上注明醋酸的质量分数≥5%.小明想:这瓶白醋中醋酸的含量是否与标签的标注相符?请你用有关酸碱的知识,定量测定白醋中醋酸的含量.
实验原理:
(1)利用中和反应可以测定酸或碱溶液中溶质的质量分数.在一定量的待测酸或碱的溶液中逐滴加入已知质量分数的碱或酸溶液(即标准溶液).直到酸碱正好完全反应.根据滴加的标准溶液的多少就可以求出待测酸或碱溶液的质量分数.
(2)用已知浓度的氢氧化钠溶液(标准液)和醋酸反应,反应的化学方程式为:CH3COOH+NaOH=CH3COONa+H2O
(3)在混合溶液中,当醋酸和氢氧化钠完全中和时,再增加1滴氢氧化钠溶液,溶液就呈碱性,而1滴氢氧化钠溶液约为0.05mL,对测定结果的影响很小,可忽略不计.
实验步骤:①用量筒量取12.0mL白醋(密度近似为1.0g/mL),倒入烧杯中,加入20mL蒸馏水稀释.
②量取45.0mL溶质质量分数为1.0%的氢氧化钠溶液(密度近似为1.0g/mL),用胶头滴管取该氢氧化钠溶液,逐滴地滴加到稀释后的白醋中,同时不断地搅拌烧杯中的溶液.滴至恰好完全反应,剩余氢氧化钠溶液5.0mL.
交流反思:
(1)在实验步骤①中,加适量水稀释白醋,对实验结果有无影响?为什么?
答:
(2)在实验步骤②中,小明如何确定醋酸和氢氧化钠已完全中和?
答:
(3)下列曲线是每次测定过程中,溶液的pH随所滴加的NaOH溶液体积的变化而变化的关系图.则符合上述实验的图线是
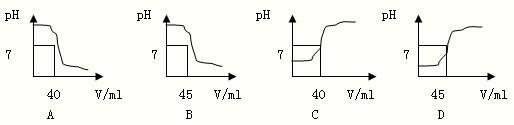
数据处理:根据实验数据,通过计算判断白醋中醋酸的含量是否与标签的标注相符?请写出计算过程.(可能用到的相对原子质量:H-1,C-12,O-16,Na-23) 查看习题详情和答案>>
实验原理:
(1)利用中和反应可以测定酸或碱溶液中溶质的质量分数.在一定量的待测酸或碱的溶液中逐滴加入已知质量分数的碱或酸溶液(即标准溶液).直到酸碱正好完全反应.根据滴加的标准溶液的多少就可以求出待测酸或碱溶液的质量分数.
(2)用已知浓度的氢氧化钠溶液(标准液)和醋酸反应,反应的化学方程式为:CH3COOH+NaOH=CH3COONa+H2O
(3)在混合溶液中,当醋酸和氢氧化钠完全中和时,再增加1滴氢氧化钠溶液,溶液就呈碱性,而1滴氢氧化钠溶液约为0.05mL,对测定结果的影响很小,可忽略不计.
实验步骤:①用量筒量取12.0mL白醋(密度近似为1.0g/mL),倒入烧杯中,加入20mL蒸馏水稀释.
②量取45.0mL溶质质量分数为1.0%的氢氧化钠溶液(密度近似为1.0g/mL),用胶头滴管取该氢氧化钠溶液,逐滴地滴加到稀释后的白醋中,同时不断地搅拌烧杯中的溶液.滴至恰好完全反应,剩余氢氧化钠溶液5.0mL.
交流反思:
(1)在实验步骤①中,加适量水稀释白醋,对实验结果有无影响?为什么?
答:
(2)在实验步骤②中,小明如何确定醋酸和氢氧化钠已完全中和?
答:
(3)下列曲线是每次测定过程中,溶液的pH随所滴加的NaOH溶液体积的变化而变化的关系图.则符合上述实验的图线是

数据处理:根据实验数据,通过计算判断白醋中醋酸的含量是否与标签的标注相符?请写出计算过程.(可能用到的相对原子质量:H-1,C-12,O-16,Na-23) 查看习题详情和答案>>